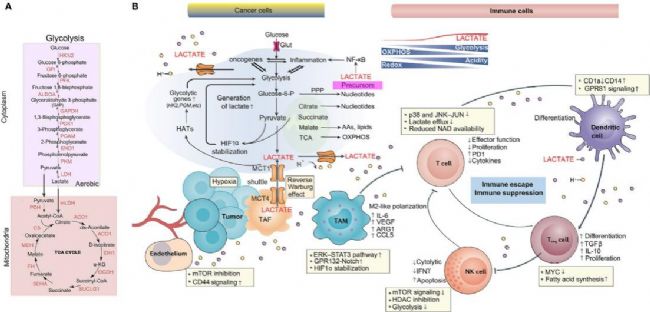
解析乳酸化修飾作為腫瘤研究新靶點的關鍵機制與治療潛力
一.化療耐藥新機制:NBS1乳酸化修復DNA雙鏈
中山大學團隊在《Nature》的研究中,首次發現DNA修復蛋白NBS1的K388位點乳酸化是腫瘤耐藥的“幕后推手”。通過分析鉑類化療耐藥的胃癌患者標本,研究人員發現耐藥腫瘤中乳酸水平顯著升高,伴隨NBS1乳酸化修飾增強。機制研究顯示,這種修飾可促進MRE11-RAD50-NBS1復合物形成,加速DNA雙鏈斷裂修復,導致化療藥物失效。臨床驗證表明,NBS1 K388乳酸化水平高的患者預后更差,而抑制乳酸生成的藥物司替戊醇能有效降低該修飾,恢復腫瘤對化療的敏感性。這一發現首次將乳酸化修飾與DNA修復通路直接關聯,為克服化療耐藥提供了新策略。
二.肝癌代謝調控密碼:AK2乳酸化驅動增殖轉移
復旦大學團隊在《Nature Metabolism》發表的研究,繪制了乙型肝炎相關肝癌的全局乳酸化修飾圖譜,鑒定出9275個修飾位點,其中非組蛋白修飾占比高達99.8%。聚焦腺苷酸激酶AK2的K28位點,發現其乳酸化修飾會抑制酶活性,進而激活糖酵解和核苷酸代謝通路,促進肝癌細胞增殖與轉移。體外實驗顯示,外源添加乳酸可顯著提升AK2 K28乳酸化水平,而阻斷該修飾能抑制腫瘤生長。這是首次在肝癌中證實乳酸化修飾對代謝酶的直接調控作用,為靶向代謝依賴型肝癌提供了潛在靶點
三.結直腸癌治療新靶標:KAT8催化乳酸化促進蛋白合成
中國醫學科學院與北京理工大學團隊在《PNAS》的研究中,揭示了賴氨酸乙酰轉移酶KAT8作為“乳酸轉移酶”的新功能。通過分析結直腸癌組織,發現KAT8可催化eEF1A2蛋白的K408位點乳酸化,增強其GTP酶活性,加速蛋白質合成,從而驅動腫瘤細胞增殖。值得注意的是,KAT8的催化活性依賴于乳酸微環境,敲除KAT8可顯著抑制高乳酸條件下的腫瘤生長,且臨床數據顯示KAT8高表達與患者不良預后密切相關。這一研究首次鑒定出乳酸化修飾的關鍵轉移酶,為開發微環境響應型抗癌藥物提供了新思路。
研究啟示:從機制解析到臨床轉化
這三項研究共同揭示了乳酸化修飾的三大核心功能:調控DNA修復介導耐藥、重塑代謝通路促進增殖、驅動蛋白合成加速癌變。值得關注的是,乳酸化修飾與腫瘤微環境的酸性特征高度協同,形成“代謝-修飾-功能”的正反饋循環。針對這一特性,聯合抑制乳酸生成(如LDHA抑制劑)與靶向特定乳酸化位點(如NBS1、AK2、KAT8)的雙重策略,或將成為突破現有治療瓶頸的關鍵。

技術支撐:乳酸化組學研究進入快車道
隨著中科新生命“奧斯卡DIA乳酸化組”技術的突破,單次檢測可鑒定超過19,000個乳酸化位點,為大規模篩選差異修飾提供了高效工具。其聯合推出的“乳酸化組學百萬支持計劃”,更以百萬級資源助力國內研究者挖掘新靶點,推動基礎研究向臨床應用轉化。 從“代謝廢物”到“信號分子”,乳酸化修飾的發現不僅改寫了腫瘤代謝調控的認知,更開啟了“代謝-修飾-靶點”一體化研究的新范式。隨著更多修飾酶與關鍵位點的解析,靶向乳酸化通路的精準治療未來可期,或將為攻克腫瘤耐藥、轉移等難題帶來革命性突破。

杭州斯達特 (www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。