微型化雙光子顯微成像助力揭示孤獨癥小鼠社交行為缺陷的神經編碼機制

社交行為是在人類社會和個體中廣泛存在的一種現象,對個體生存和人類社會繁衍至關重要。“喜新厭舊”似乎是絕大多數生物個體行為的本性,與陌生個體互動帶來的新鮮感往往能給生活增添更多的驚喜。然而,由于存在不同程度的社交功能障礙,孤獨癥癥譜系障礙(Autism spectrum disorder, ASD)患者往往不能體會到結識新朋友的快樂,也難以和陌生人進行正常的人際交往。那么,ASD患者腦內到底何種神經功能紊亂導致其產生“喜新厭舊”等社交行為缺陷的呢?針對該問題,研究團隊以MECP2轉基因(MECP2-TG)孤獨癥模型小鼠為研究對象,展開了一系列深入探索。
研究團隊分別讓頭戴微型化雙光子顯微鏡的野生型小鼠(WT)和孤獨癥模型小鼠(MECP2-TG)在改進的兩箱社交行為學裝置中自由探索(圖1A and 1B),在小鼠進行社交探索行為的同時采集前額葉前邊緣皮質(Prelimbic cortex, PrL)神經元鈣熒光信號。行為學箱體兩側分別放有一只“陌生”小鼠(New)和一只“熟悉”小鼠(Old)。首先,研究人員發現,正常小鼠在社交上存在典型的“喜新厭舊”樣行為,而MECP2-TG孤獨癥模型小鼠存在“喜新厭舊”行為缺陷(圖1C)。
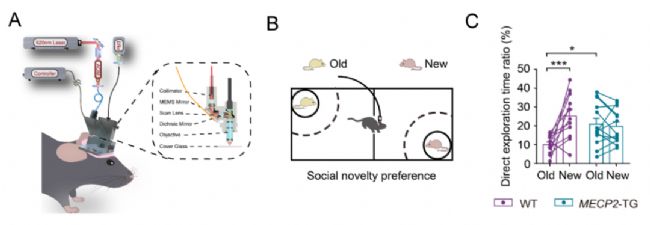
圖1. (A)二代微型雙光子顯微鏡裝置圖(B)小鼠行為學實驗設計(C)社交探索時間統計結果
先前研究[1,2]認為,內側前額葉PrL腦區編碼和社交活動相關的多種行為信息。然而,目前有關PrL腦區是如何編碼不同類型社交對象信息的仍不甚明了。研究人員借助WT和MECP2-TG孤獨癥模型小鼠,結合神經元胞體識別和功能集群發掘算法(圖2A),首次發現了在小鼠PrL腦區內存在稀疏分布、特定響應“陌生”或“熟悉”小鼠社交偏好的抑制性中間神經元集群,分別將其命名為NewPNs(圖2B)和OldPNs(圖2C),它們就像區分不同社交對象的“指示燈”,會在遇到特定“陌生”或“熟悉”社交對象小鼠時特異性激活。
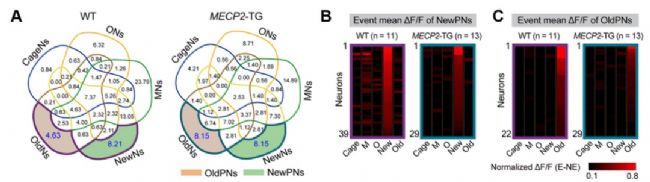
圖2. 鑒定“陌生”和“熟悉”小鼠社交偏好特異性響應神經元,揭示其在MECP2-TG小鼠中的功能缺陷
獨特的偏好響應模式引起了研究團隊的興趣。研究人員進一步利用鈣信號定量分析范式,實現了對不同類型社交對象特異性偏好響應神經元的激活概率、鈣信號幅度、達峰時間和功能連接強度等多種動力學特征和復雜網絡參數的自動計算和統計。結果發現,同與“陌生”對象社交相比,與“熟悉”對象進行社交更能引起野生型小鼠OldPNs較之于NewPNs更加強烈的激活,這兩種不同的細胞集群可通過“蹺蹺板”式協同增強效應,特異性調控小鼠的“喜新厭舊”行為。而孤獨癥模型小鼠OldPNs動力學卻明顯失去“熟悉”對象特異性激活的動力學特征,處理“熟悉”社交對象時效率顯著減弱,導致其無法區分不同社交對象之間的差別,進而引發“喜新厭舊”樣社交行為缺陷(圖3)。
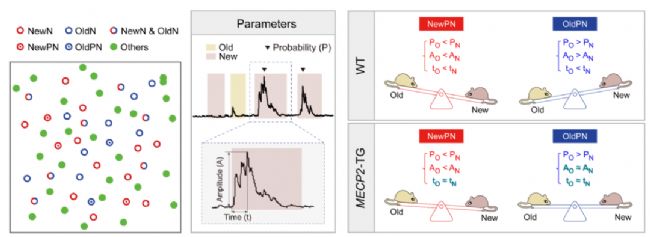
圖3. 社交偏好特異性響應神經元集群鈣信號動力學分析結果示意圖
上述結果表明,在小鼠PrL腦區內存在一群稀疏分布的中間神經元集群,分別負責編碼社交行為中的“熟悉”和“陌生”等不同社交對象信息。在MECP2-TG孤獨癥模型小鼠中,上述特異性編碼不同社交對象的神經集群出現了顯著的功能異常,最終導致了社交行為缺陷。不僅如此,研究人員還通過借助CRISPR-Cas9基因編輯技術,在MECP2-TG小鼠PrL腦區中間神經元內特異性去除外源性MECP2轉基因后,可顯著挽救孤獨癥小鼠“喜新厭舊”樣缺陷表型。同時,得益于數據處理的標準化范式,研究人員很快復現了動力學分析結果,并發現MECP2-TG小鼠中NewPNs和OldPNs對“熟悉”小鼠社交探索行為的響應效率得到顯著提升,進一步證明了社交行為同相關神經集群活動之間的強因果關系(圖4)。
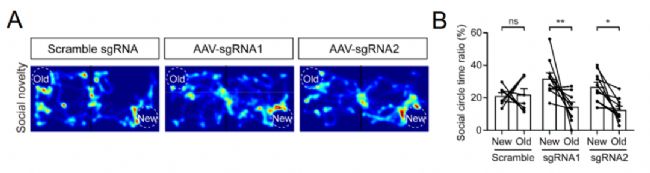
圖4. MECP2-TG小鼠PrL腦區抑制性中間神經元內靶向特異性去除外源性MECP2轉基因,可顯著挽救孤獨癥模型小鼠“喜新厭舊”樣行為缺陷
綜上所述,該研究不僅深入解析了小鼠“喜新厭舊”社交行為的皮層神經元編碼機制,也為靶向干預前額葉皮層特異類型神經元,治療孤獨癥等神經精神疾病患者的社交行為障礙提供了寶貴線索。

超維景自主研制的快速高分辨微型化雙光子顯微成像系統(Fast high-resolution miniature two photon microscopy, FHIRM-TPM),在全球首次獲取了小鼠在自由行為過程中大腦神經元和神經突觸活動的清晰、穩定的動態圖像。
其產品具有高分辨、大視野等多個型號,可在動物自由活動狀態下,約150 μm變焦和多平面快速切換的實時成像,并可對同一批神經元長期穩定跟蹤。
結合光遺傳模塊,還可以在結構與功能成像的同時,精準地操控神經元和大腦神經回路的活動。
FHIRM-TPM為研究大腦的結構和功能提供了一個革命性的新工具,可融合微觀神經元和神經突觸活動與大腦整體的信息處理和個體行為信息,成為全景式解析腦連接圖譜和功能動態圖譜的利器!
參考文獻:
[1] Murugan, Malavika, et al. "Combined social and spatial coding in a descending projection from the prefrontal cortex." Cell 171.7 (2017): 1663-1677.
[2] Huang, Wen-Chin, et al. "Social behavior is modulated by valence-encoding mPFC-amygdala sub-circuitry." Cell reports 32.2 (2020): 107899.