Amyloid β-Peptide的結構、作用機制及在科研中的應用
在神經(jīng)科學與分子生物學研究領域,Amyloid β-Peptide (β-Amyloid ,β淀粉樣蛋白,AbMole,M1555)始終是一個備受矚目的焦點。Amyloid β-Peptide在阿爾茨海默癥(Alzheimer's disease,AD)的發(fā)展過程中起到了重要作用,它也是研究神經(jīng)退行性變化的重要靶點。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細胞因子、人源單抗、天然產(chǎn)物、熒光染料、多肽、靶點蛋白、化合物庫、抗生素等科研試劑,全球大量文獻專利引用。
參考文獻及鳴謝
Amyloid β-Peptide的結構與生理活性
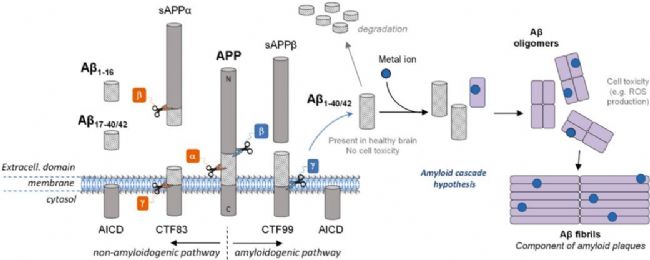
Amyloid β-Peptide(AbMole,M1555)是一種來源于淀粉樣前體蛋白(Amyloid Precursor Protein,APP)的多肽。APP 是一種跨膜糖蛋白,廣泛存在于多種細胞類型中。Amyloid β-Peptide(AbMole,M1555)的生成過程涉及一系列復雜的酶促反應,主要包括 β-分泌酶(β-secretase)和 γ-分泌酶(γ-secretase)對APP的連續(xù)切割。首先,β-分泌酶在 APP 的細胞外區(qū)域進行切割,產(chǎn)生一個較大的C-終端片段。隨后,γ-分泌酶進一步作用于 CTF,最終釋放出Amyloid β-Peptide肽段。這一生成過程受到多種因素的精細調(diào)控,包括細胞內(nèi)信號通路、酶的活性以及細胞環(huán)境等。研究發(fā)現(xiàn),Amyloid β-Peptide(β淀粉樣蛋白,β-Amyloid)的生成水平在不同生理狀態(tài)下存在差異,其生成的調(diào)控機制也成為當前研究的熱點之一。

圖1. Amyloid β-Peptide的切割和聚集示意圖[1]
盡管 Amyloid β-Peptide(AbMole,M1555)在病理狀態(tài)下與神經(jīng)退行性變化密切相關,但在正常生理條件下,它也具有一些重要的生理功能。Amyloid β-Peptide可以參與調(diào)節(jié)神經(jīng)細胞的生長、發(fā)育和突觸可塑性。它能夠與神經(jīng)細胞表面的多種受體相互作用,影響神經(jīng)細胞的信號傳導過程。
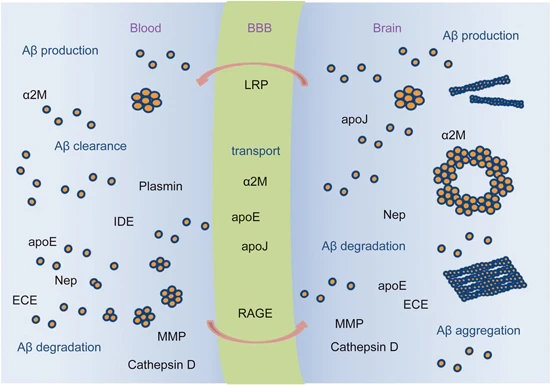
Amyloid β-Peptide(AbMole,M1555)可通過多種途徑被清除,包括被蛋白酶 Neprilysin (Nep)、內(nèi)皮素轉換酶 (ECE)、胰島素降解酶 (IDE)、纖溶酶和其他 Aβ 降解蛋白酶(MMP、組織蛋白酶 D)等降解,以及被小膠質(zhì)細胞介導的途徑清除(圖1)[2]。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內(nèi)實驗,相關科研成果發(fā)表于頂刊 Nature 和 Nature Medicine。

圖2. Amyloid β-Peptide的聚集、運輸、降解和清除[2]。
Amyloid β-Peptide的聚集和神經(jīng)退行性變化
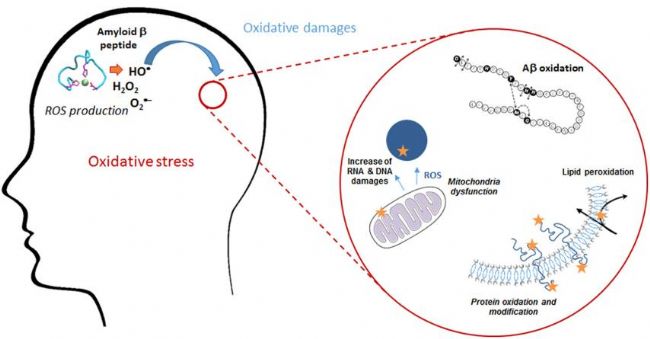
Amyloid β-Peptide(AbMole,M1555)可以聚集形成淀粉樣斑塊(Amyloid plaques),上述聚集過程受到多種因素的影響,包括其自身的氨基酸序列、細胞外環(huán)境的 pH 值、離子濃度以及與其他蛋白質(zhì)的相互作用等。研究表明,Amyloid β-Peptide的聚集過程是一個動態(tài)的過程,從單體狀態(tài)到寡聚體狀態(tài),再到最終的纖維狀結構,每一步都伴隨著分子間相互作用的變化。Amyloid β-Peptide的聚集對神經(jīng)細胞產(chǎn)生了一系列的毒性作用。它可以誘導神經(jīng)細胞的氧化應激反應,產(chǎn)生大量的活性氧(ROS),導致細胞內(nèi)的氧化還原平衡失調(diào)(圖2)。此外,Amyloid β-Peptide的聚集還可以激活神經(jīng)細胞內(nèi)的多種信號通路,例如使Tau蛋白過度磷酸化并引起炎癥反應,這可能導致神經(jīng)元死亡。

圖3. Amyloid β-Peptide聚集形成的淀粉樣斑塊誘導神經(jīng)細胞的氧化應激[1]
Amyloid β-Peptide在科研中的應用
Amyloid β-Peptide(AbMole,M1555)在多個領域中有著廣泛的應用。從基礎分子機制研究到復雜的細胞與動物模型構建,再到生物標志物的開發(fā),Amyloid β-Peptide都是不可或缺的工具。
1.Amyloid β-Peptide在細胞實驗中的應用
在細胞水平上,Amyloid β-Peptide(AbMole,M1555)廣泛應用于構建神經(jīng)退行性疾病的細胞模型。通過向細胞培養(yǎng)基中添加 Amyloid β-Peptide,可以誘導神經(jīng)細胞的氧化應激、炎癥反應和細胞凋亡。這些細胞模型為研究Amyloid β-Peptide(β-Amyloid)的細胞毒性機制提供了直接的實驗平臺。例如,Amyloid β-Peptide能夠下調(diào)抗凋亡蛋白bcl-2并上調(diào)促凋亡蛋白bax的表達,從而誘導神經(jīng)細胞凋亡[3]。
2.動物模型研究中的應用
在動物實驗中,Amyloid β-Peptide (AbMole,M1555)同樣發(fā)揮著關鍵作用。Amyloid β-Peptide可作為動物實驗造模劑使用,例如通過將 Amyloid β-Peptide注入動物大腦,可以誘導其在大腦中形成淀粉樣斑塊,構建阿爾茨海默癥等神經(jīng)退行性變化模型。這些動物模型為研究神經(jīng)炎癥反應、神經(jīng)細胞死亡以及認知功能障礙提供了更為真實的實驗平臺[4]。上述方法相較于轉基因動物而言,能夠快速誘導局部的神經(jīng)炎癥反應和神經(jīng)退行性變化,適合研究 Amyloid β-Peptide(β淀粉樣蛋白)對特定腦區(qū)或神經(jīng)環(huán)路的影響。
3.Amyloid β-Peptide作為生物標志物
Amyloid β-Peptide(AbMole,M1555)在生物標志物研究中也具有重要的應用。Amyloid β-Peptide(Aβ1-42)及其代謝產(chǎn)物在生物體液中的水平變化可作為神經(jīng)退行性變化的潛在生物標志物。此外,Amyloid β-Peptide 的聚集狀態(tài)和修飾形式也可作為生物標志物的候選指標。通過開發(fā)高靈敏度和高特異性的檢測方法,研究人員可以更準確地檢測 Amyloid β-Peptide 在聚集和修飾等方面的變化[5]。
4.結構分析和藥物篩選
Amyloid β-Peptide(AbMole,M1555)是研究相關蛋白質(zhì)折疊和聚集機制的重要模型。其氨基酸序列使其具有易于聚集的特性,這種聚集過程在分子水平上為研究蛋白質(zhì)的構象變化提供了絕佳的樣本。通過核磁共振(NMR)和冷凍電鏡等技術,研究人員能夠深入解析 Amyloid β-Peptide 的結構特征,揭示其從單體到寡聚體再到纖維狀結構的轉變機制[6]。Amyloid β-Peptide也可用于藥物篩選,例如通過研究Amyloid β-Peptide的聚集或分解途徑,科研人員已經(jīng)開發(fā)出一些抗聚集劑[2]。此外,由于Amyloid β-Peptide(AbMole,M1555)可以誘導神經(jīng)細胞的氧化應激、炎癥反應、細胞凋亡,利用 Amyloid β-Peptide誘導的細胞和動物模型,研究人員可以篩選具有抗氧化、抗炎和抗凋亡作用的化合物,以評估其對 Amyloid β-Peptide 誘導的神經(jīng)毒性的保護效果[7]。也有研究表明,Amyloid β-Peptide(β淀粉樣蛋白)可以通過調(diào)節(jié)膽堿能系統(tǒng)來影響神經(jīng)元的興奮性和突觸傳遞,這為開發(fā)針對膽堿能系統(tǒng)的抑制劑提供了基礎[7]。
5.不同長度Amyloid β-Peptide的應用區(qū)別
不同長度的β-淀粉樣蛋白(Amyloid β-Peptide,Aβ)在實驗中表現(xiàn)出顯著的差異,這些差異主要體現(xiàn)在聚集特性、結構穩(wěn)定性、神經(jīng)毒性以及在疾病模型中的作用等方面。以下是一些常見長度的Aβ肽在實驗中的差別:
- Amyloid β-Protein 25-35(β-Amyloid 16-22,Aβ 25-35)
β-Amyloid 25-35(Amyloid β-Protein 25-35,Aβ 25-35,AbMole,M28442)是Aβ肽的一個關鍵片段,能夠促進Aβ的聚集。它可以通過與完整的Aβ肽或其他片段相互作用,形成寡聚體和纖維。Aβ25-35在神經(jīng)毒性方面表現(xiàn)出顯著的作用,能夠誘導神經(jīng)元細胞內(nèi)的鈣離子穩(wěn)態(tài)失衡,激活細胞內(nèi)信號通路,導致細胞凋亡,Aβ25-35(AbMole,M28442)多用于細胞層面的實驗研究。
- Amyloid β-Peptide 1-42(Aβ1-42)和Amyloid β-Peptide 1-40(Aβ1-40)
Amyloid β-Peptide (1-42)(β-Amyloid1-42,Aβ1-42,AbMole,M1555)比Amyloid β-Peptide (1-40)(β-Amyloid1-40,Aβ1-40,AbMole,M10194)更容易聚集。β-Amyloid1-42由于多出兩個氨基酸(Ile-41和Ala-42),其疏水性和β-折疊傾向更強,因此更容易形成穩(wěn)定的淀粉樣纖維,導致Aβ1-42的神經(jīng)毒性更強。Aβ1-42形成的寡聚體和纖維能夠更有效地破壞神經(jīng)元細胞,導致細胞內(nèi)鈣離子失衡和氧化應激,最終引起細胞死亡。Amyloid β-Peptide 1-42主要用于動物阿爾茲海默癥的造模。
- Amyloid β-Peptide 16-22
Amyloid β-Peptide 16-22(β-Amyloid16-22,Aβ16-22,AbMole,M52460)是Aβ肽中富含疏水氨基酸的片段,這一部分在Aβ的聚集過程中起關鍵作用。Aβ16-22能夠快速自組裝形成寡聚體和纖維,且在疏水-親水界面上的聚集能力更強。由于其較短且易于聚集的特性,因此更容易形成穩(wěn)定的淀粉樣纖維。在實驗中,Aβ16-22常被用于模擬Aβ的早期聚集過程[8]。
范例詳解
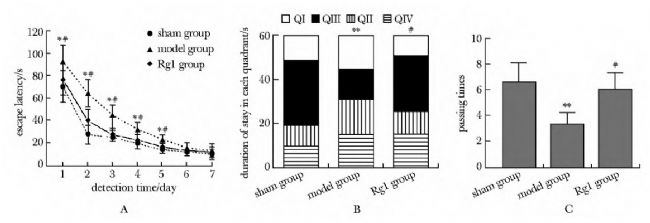
科研人員探究了三七皂苷Rg1(notoginsenoside Rg1)保護神經(jīng)系統(tǒng)并抑制阿爾茨海默癥(Alzheimer's disease,AD)的作用機制。實驗人員對SD大鼠側腦室注射了由AbMole提供的Amyloid β-Peptide(Aβ1-42,β淀粉樣蛋白,AbMole,M1555)以構建AD大鼠模型,將大鼠隨機分為3組(假手術組、模型組和三七皂苷Rg1治療組)。Morris水迷宮實驗(MWM)用于檢測大鼠學習和記憶行為能力變化,化學比色法試劑盒檢測大腦皮質(zhì)丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性,免疫組織化學法檢測大腦皮質(zhì)中caspase-3蛋白含量,Western blot檢測p38和p-p38蛋白表達水平。最終發(fā)現(xiàn)三七皂苷Rg1可顯著改善AD模型大鼠的學習記憶能力,增加抗氧化能力,抑制神經(jīng)細胞凋亡并起到神經(jīng)系統(tǒng)保護作用。

圖4. 水迷宮檢測大鼠學習與記憶行為結果[8]

參考文獻及鳴謝
[1] CHEIGNON C, TOMAS M, BONNEFONT-ROUSSELOT D, et al. Oxidative stress and the amyloid beta peptide in Alzheimer's disease [J]. Redox biology, 2018, 14: 450-64.
[2] CHEN G F, XU T H, YAN Y, et al. Amyloid beta: structure, biology and structure-based therapeutic development [J]. Acta pharmacologica Sinica, 2017, 38(9): 1205-35.
[3] PARADIS E, DOUILLARD H, KOUTROUMANIS M, et al. Amyloid beta peptide of Alzheimer's disease downregulates Bcl-2 and upregulates bax expression in human neurons [J]. The Journal of neuroscience : the official journal of the Society for Neuroscience, 1996, 16(23): 7533-9.
[4] FACCHINETTI R, BRONZUOLI M R, SCUDERI C. An Animal Model of Alzheimer Disease Based on the Intrahippocampal Injection of Amyloid β-Peptide (1-42) [J]. Methods in molecular biology (Clifton, NJ), 2018, 1727: 343-52.
[5] <β淀粉樣蛋白生物標志物在阿爾茨海默病臨床應用中的價值探討.pdf> [J].
[6] GREMER L, SCHöLZEL D, SCHENK C, et al. Fibril structure of amyloid-β(1-42) by cryo-electron microscopy [J]. Science (New York, NY), 2017, 358(6359): 116-9.
[7] RICHTER K, OGIEMWONYI-SCHAEFER R, WILKER S, et al. Amyloid Beta Peptide (Aβ(1-42)) Reverses the Cholinergic Control of Monocytic IL-1β Release [J]. Journal of clinical medicine, 2020, 9(9).
[8] ITOH S G, OKUMURA H. Promotion and Inhibition of Amyloid-β Peptide Aggregation: Molecular Dynamics Studies [J]. International journal of molecular sciences, 2021, 22(4)
標簽:
Amyloid
神經(jīng)退行性變化
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com