淀粉樣蛋白Aβ的形成與聚集及在阿爾茨海默病(AD)的診斷中作用
阿爾茨海默病(AD)是一種進行性神經退行性疾病,其嚴重程度通常從輕度認知障礙逐漸發展到重度癡呆,嚴重影響患者的日常生活能力和認知功能。全球AD患者人數已達到5500萬,預計到2050年將增長至1.39億。在中國,2021年現存的AD及其他癡呆患者人數已接近1700萬。AD生物標志物Aβ靶向藥Aducanumab和Lecanemab的FDA獲批標志著Aβ靶向治療進入新階段,目前仍有多款其他Aβ靶向藥進入臨床試驗。這些藥物通過清除腦內Aβ斑塊延緩認知衰退,結合生物標志物實現早期精準診斷。
2024年12月31日,國家衛生健康委等15個部門聯合印發《應對老年期癡呆國家行動計劃(2024—2030年)》,各部門聯合開展老年癡呆篩查與早期干預,AD檢測持續火熱。
Aβ
Aβ即淀粉樣蛋白沉積(amyloid-β),是淀粉樣前體蛋白(APP)經過β-分泌酶(BACE1)和γ-分泌酶的連續切割而生成的4kDa片段。Aβ的異常積累是AD的核心病理特征之一,Aβ的沉積不僅引發神經原纖維纏結、氧化應激、小膠質細胞激活、突觸功能障礙和神經元丟失等一系列病理變化,而且這些變化在時間和空間上與AD的認知和功能衰退密切相關.
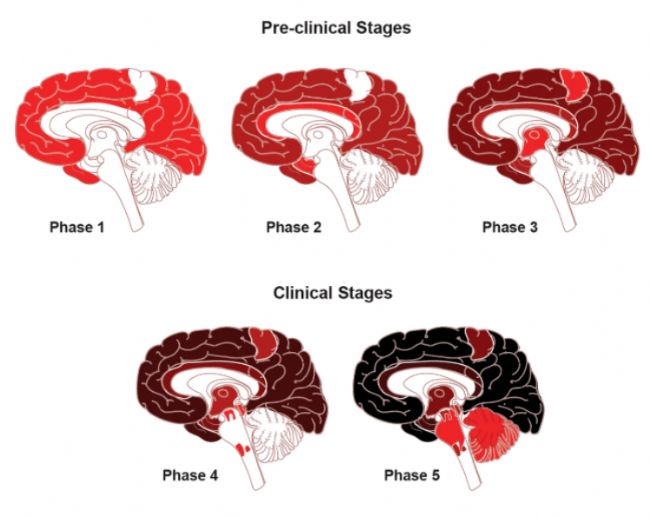
圖1 Aβ的傳統神經病理分期。
Aβ的形成與聚集
Aβ(β-淀粉樣蛋白)的形成過程主要涉及淀粉樣前體蛋白(APP)的兩種酶切途徑:
1. 非淀粉樣途徑(神經保護性)
APP被α-分泌酶(屬于ADAM家族)切割,切割位點位于Aβ序列內部(如Aβ16-17之間),阻止Aβ生成。此過程產生可溶性胞外片段sAPPα和膜結合的C83片段,后者進一步被γ-分泌酶切割為P3肽和APP胞內結構域(AICD)。
2. 淀粉樣途徑(病理性)
APP首先被β-分泌酶(BACE1)切割,產生可溶性sAPPβ和膜結合的C99片段。隨后,γ-分泌酶復合體(含Presenilin 1/2、Nicastrin、PEN2、APH-1)切割C99的跨膜區(通常在Aβ40或Aβ42的C端),釋放Aβ40或Aβ42到細胞。Aβ42因C端多兩個疏水氨基酸(Ile41、Ala42),更易聚集形成神經毒性寡聚體和斑塊。Aβ40雖含量更高,但聚集傾向較低,通常作為次要病理形式。
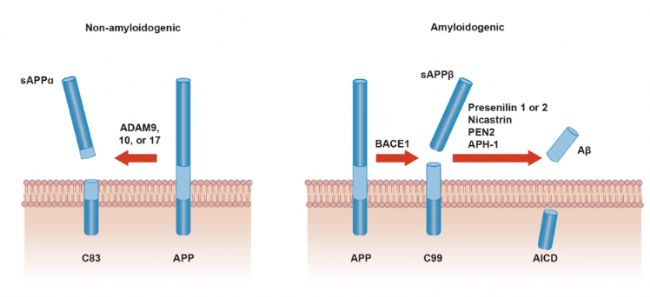
圖2 Aβ的形成路徑
Aβ(β-淀粉樣蛋白)的聚集形式包括單體、二聚體、寡聚體、原纖維、纖維和淀粉樣斑塊,這些形式通過動態平衡相互轉化,其特性由聚集尺寸、構象狀態及溶解度決定,其中纖維和淀粉樣斑塊為不溶性結構。單體Aβ(如Aβ1-40和Aβ1-42)是聚集的起始單位,可進一步形成可溶性的低聚體(如二聚體、三聚體及多聚體),這些寡聚體具有神經毒性并參與突觸損傷。隨著聚集進程,可溶性寡聚體逐漸轉化為原纖維,最終形成不可溶的纖維和細胞外淀粉樣斑塊,這一過程受脂質相分離等分子機制調控。不同Aβ亞型(如N端截斷變異體)及病理條件(如pH、金屬離子濃度)會顯著影響其聚集路徑和毒性效應。
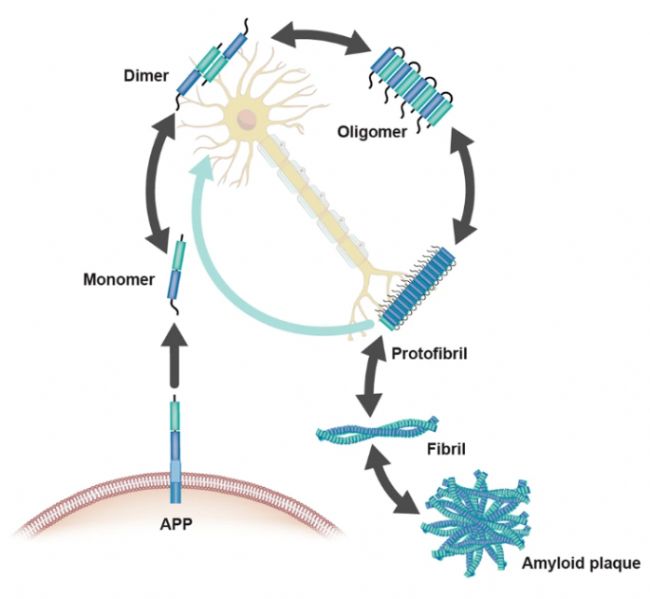
圖3 Aβ的聚集
AD生物標志物
賈建平教授團隊通過對中國人群長達20年的縱向隊列研究,發現Aβ異常最早出現,診斷前18年即出現腦脊液Aβ變化,隨后Aβ42/40比值在診斷前14年顯著改變。磷酸化tau(p-tau181)和NFL隨后升高。
Vasilios C. Constantinides研究中指出CSF中Aβ42/Aβ40比值在區分AD病理與非AD病理方面表現出更高的診斷準確性。Aβ42/Aβ40比值的AUC(曲線下面積)為0.939,而單一的Aβ42的AUC為0.831。這表明Aβ42/Aβ40比值在區分AD病理方面具有更高的敏感性和特異性(p < 0.001)。通過BIOMARKAPD/ABSI標準重新分類患者后,Aβ42/Aβ40比值在區分AD與非AD病理方面仍然表現出較高的準確性。
Shogyoku Bun研究中使用了全自動高靈敏度化學發光酶聯免疫分析(HISCL)平臺測量血漿中的Aβ42/Aβ40比值,血Aβ42/Aβ40比值在識別淀粉樣蛋白PET陽性狀態方面表現出色,AUC值為0.949,顯示出血漿中的Aβ42/Aβ40極高的診斷準確性。血漿Aβ42/Aβ40比值在檢測早期淀粉樣蛋白積累方面具有潛力,特別是在“灰色區域”(即初步淀粉樣病變階段)中,顯示出較高的敏感性和特異性。在與其他潛在的血漿生物標志物(如p-tau181、GFAP和NfL)的比較中,Aβ42/Aβ40比值顯示出較高的診斷性能,特別是在整個患者群體和健康對照組中。
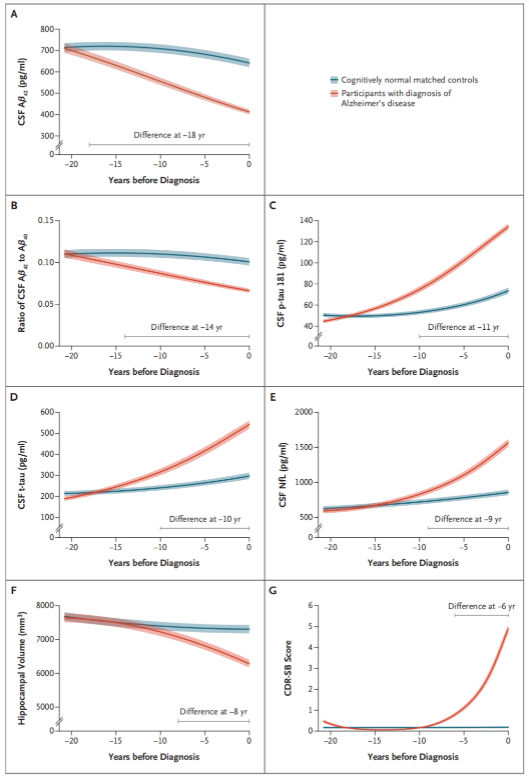
圖4 不同AD生物標志物變化的時間軌跡
Aβ(β-淀粉樣蛋白)在阿爾茨海默病(AD)的診斷中至關重要。Aβ42/Aβ40比值作為核心生物標志物,能早期、準確地區分AD患者與健康人群,其高敏感性和特異性為早期診斷提供了有力支持。未來,隨著檢測技術的進步和標準化,Aβ檢測有望在普通人群中大規模應用,實現AD的早期篩查和干預,從而改善患者預后。
S-RMab®單克隆抗體
斯達特上新高靈敏Aβ42和Aβ40重組兔單抗原料,助力AD診斷。
Aβ 40配對推薦

Aβ 42配對推薦
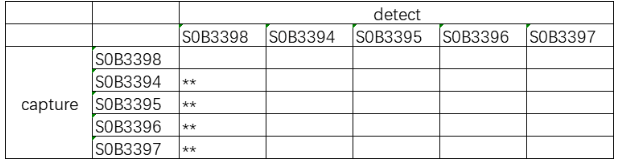
產品信息
參考文獻
[1] https://doi.org/10.1038/s41380-021-01249-0
[2] doi: 10.1056/NEJMoa2310168.
[3] https://doi.org/10.3390/diagnostics13040783
[4] https://doi.org/10.1186/s13195-023-01296-5
杭州斯達特 (www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。