IL-33 經 OX40L 促進人肥大細胞誘導 CD4+ T 細胞產生 IL-9
IL-33-primed human mast cells drive IL-9 production by CD4+ effector T cells in an OX40L-dependent manner
Keywords: IL-33; IL-9; OX40L; Th cell; mast cell.
2 型免疫反應是針對皮膚和粘膜中的主要組織損傷而建立的。在上皮中感應到有害刺激,并誘導釋放警報素,如胸腺基質淋巴細胞生成素(TSLP)、白細胞介素-25(IL-25)和 IL-33,這些警報素會啟動組織駐留的前哨細胞,并誘導樹突狀細胞成熟,隨后在引流淋巴結中產生輔助型T細胞2(Th2)反應。一旦浸潤到受傷組織中,Th2 細胞就會接收到免疫環境提供的確認信號,這些信號不僅加強而且塑造了它們的極化,并導致受損組織內 2 型細胞因子(IL-4、IL-5、IL-9 和 IL-13)的微妙組合。
據報道,在抗原呈遞過程中,IL-33活化的樹突狀細胞(DCs)會促進 Th 細胞中 IL-5、IL-13 和 IL-9 的產生。此外,2 組先天淋巴細胞(ILC2)通過與 Th2 細胞的直接相互作用來促進局部 Th2 反應。除了 ILC2 和樹突狀細胞外,已知肥大細胞(MCs)也會促進 Th2 反應,但其潛在機制仍知之甚少。
MCs 是先天免疫細胞,在皮膚和粘膜中特別豐富,與 ILC2 一樣,由警報素,尤其是 IL-33 啟動 。MCs 高度表達 ST2(IL-33受體),并受到 IL-33 的強烈刺激,促進細胞成熟、細胞因子和趨化因子的產生。已知 MCs 會影響適應性免疫反應,并根據免疫情況表現為對 T 細胞反應的激活或抑制作用。
基于此,法國圖盧茲的癌癥治療中心及圖盧茲第三大學的研究人員在一項研究中探索了 IL-33 對人類 MC 與 Th 細胞的相互作用并對其極化能力的影響。研究發現 IL-33 介導的 MCs 促進了 Th2 細胞反應,并允許產生 IL-9 的 Th 細胞以 OX40L 依賴性方式出現。研究成果發表于 Frontiers in Immunology 期刊題為“IL-33-primed human mast cells drive IL-9 production by CD4+ effector T cells in an OX40L-dependent manner”。
首先,為了分析 IL-33 激活 MCs 的影響及其對 Th 細胞反應的后續影響,研究人員設計了一個共培養系統,以外周血 CD4+ 記憶 T 細胞與 MCs 共培養(圖1 A),發現無論是否啟動 IL-33,都增加了 CD4+ T 細胞表面的增殖(圖1 B)和早期(CD69 和 CD25)或晚期(CD137)激活標志物的表達,表明 MCs 獨立于 IL-33向 CD4+ T 細胞提供激活信號。
然后,分析了共培養 6 天后 CD4+ T 細胞產生的典型 Th 細胞細胞因子(IFN-γ、IL-17、IL-4、IL-13 和 IL-9)。結果觀察到,未激活的 MCs 增加了產生這些細胞因子的 CD4+ T 細胞的百分比,表明 MCs 的存在促進了 T 細胞細胞因子的產生(圖1 C)。用 IL-33(MCIL-33)激活的 MCs 顯著增加了 IL-9+(在較小程度上還有 IL-13+)CD4+ T 細胞的百分比,降低了 IL-17+ T 細胞的百分比,而不影響 IFN-γ+ 或 IL-4+ T 細胞的比例(圖1 C)。此外,在 MCIL-33 存在下,IL-9+ 細胞的數量增加(圖1 D)。這些結果表明,IL-33 增強了 MCs 驅動 Th 細胞產生 IL-13 和 IL-9 的能力。
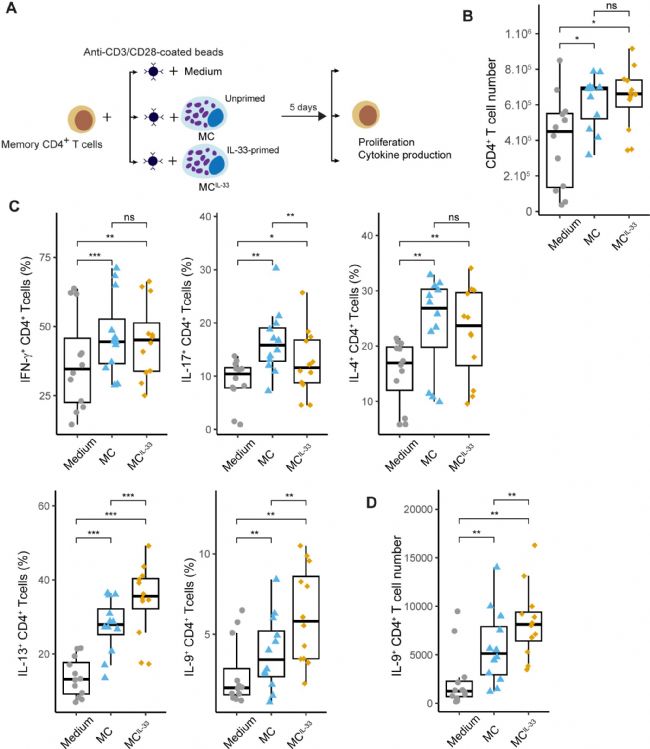 圖1 IL-33 激活的 MC 驅動活化的 CD4+ Th 細胞產生 IL-9 。
圖1 IL-33 激活的 MC 驅動活化的 CD4+ Th 細胞產生 IL-9 。
由于 IL-33 賦予 MCs 促進 Th 細胞產生 IL-9 的能力,因此接下來試圖闡明這種現象的潛在機制。研究人員探討了 IL-33 刺激后 MCs 中上調的基因是否可能在 MCs 和活化的記憶 CD4+ T 細胞之間的相互作用中發揮作用。基于RNAseq 數據和公開數據集檢索,發現 IL-33 在 MCs 中上調了參與 T 細胞共刺激的幾種分子的表達,如 CD80、CD58、ICAM1 和 TNF 超家族(TNFSF)分子 CD70(TNFSF7)、OX40L(TNFSF4)和 CD137L(TNFSF9)(圖2 A、B)。在這些分子中,實驗專注于 OX40L,因為它被證明與 Th2 驅動有關。
流式細胞術證實,IL-33 誘導 MC 表面的 OX40L 表達(圖2 C、D)。由于其他 2 型反應警報素可能啟動 MCs,并且據報道,在人 CD11c+ DCs 中,OX40L 表達響應 TSLP 而不是 IL-33,因此,分析了 TSLP 和 IL-25 啟動 MC 的影響,發現這些警報素不會誘導 MC 表面的 OX40L 表達。為了測試 OX40/OX40L 共刺激對 Th 細胞極化的影響,使用抗-OX40L 阻斷單克隆抗體 oxelumab。添加 oxelumab 顯著損害了 MC 增加 IL-9 + Th 細胞百分比的能力(圖2 E、F)。還注意到在 oxelumab 的存在下降低了 IL-13 + Th 細胞比例的趨勢。這些結果表明,在共培養系統中,需要 OX40 刺激來促進 Th 細胞產生 IL-9(在較小程度上是 IL-13)。
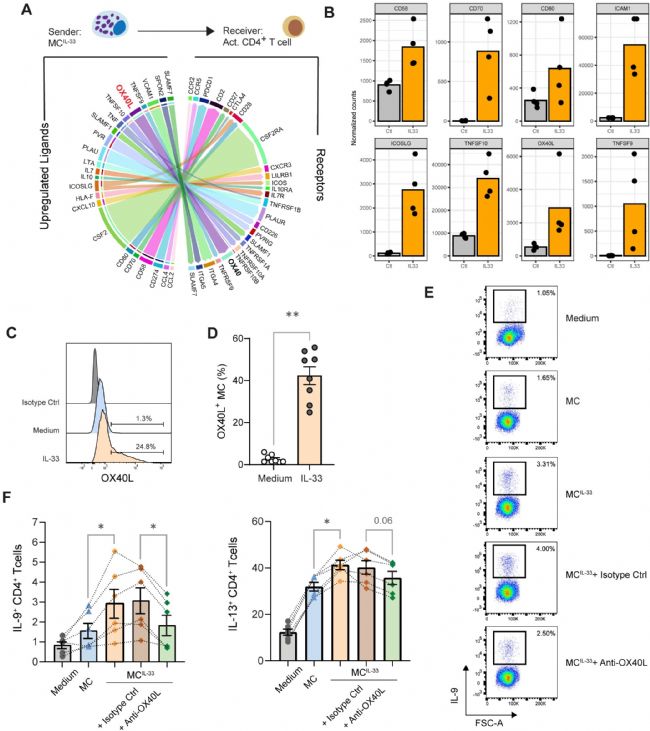 圖2 MCs 中 IL-33 誘導的 OX40L 促進 Th 細胞中 IL-9 的產生。
圖2 MCs 中 IL-33 誘導的 OX40L 促進 Th 細胞中 IL-9 的產生。
以往研究表明,干擾素-γ(IFN-γ)在 MCs(MHC-II類分子和共刺激分子)中誘導抗原呈遞細胞(APC)表型,因此實驗測試了 IL-33 是否也作用于 MCs 在同源相互作用時極化 Th 細胞的能力。用 IFN-γ 刺激 MCs 48 小時來誘導 MCs 的 APC 表型,并分析 IL-33 啟動對其表型(CD54、HLA II 類分子和 OX40L 表達)的影響。結果表明,IL-33 與 IFN-γ 協同誘導 MHC II 類分子和 CD54,但 IFN-γ 不影響 MC 表面的 OX40L 表達。
IFN-γ刺激的 MCs 用細菌超抗原混合物脈沖,以激活大部分多克隆記憶 CD4+ T 細胞群,并與 CD4+ 記憶 T 細胞共培養 6 天(圖3 A)。實驗觀察到,SAg-脈沖 MC 有效地刺激了多克隆 T 細胞增殖,并且 IL-33 啟動不會改變 MCs 刺激 CD4+ T 細胞增殖的能力(圖3 B),表明 IL-33 不會改變 MCs 激活效應性T細胞(Teff)細胞的潛力。
為了檢測共培養時是否確實發生了 MCIL-33-Th 細胞同源相互作用以及 OX40L 是否參與免疫突觸(IS),在共培養后 2 小時通過共聚焦激光掃描顯微鏡分析了 IS 的形成。共培養 2 小時后,發現大約 10% 的 IFN-γ刺激的 MCIL-33 與記憶 CD4+ T 細胞偶聯,表明 MCIL-33-CD4+ T 細胞同源相互作用確實發生。分析偶聯物在細胞間接觸區域的 OX40L 和 OX40 富集情況,觀察到大約一半的偶聯物在 IS 處顯示 OX40L 富集,這表明 Th 細胞 OX40 在與 MCs 的同源相互作用時參與共刺激(圖3 C-E)。
最后,分析了 Th 細胞在共培養第 6 天產生的細胞因子(圖3 F)。IL-33 介導的 MCs能夠增加 IL-9+ 和 IL-13+ Th 細胞的比例以及降低 IL-17+ Th 細胞的百分比(圖3 F)。阻斷抗-OX40L mAb 的添加表明 IL-9 + Th 細胞分化需要 OX40-OX40L 相互作用(圖3 G、H)。這些結果表明,用 IFN-γ 預處理的 MCIL-33 能夠以同源方式刺激記憶 CD4+ T 細胞,并通過 OX40L 表達促進 IL-9+ Th 細胞。
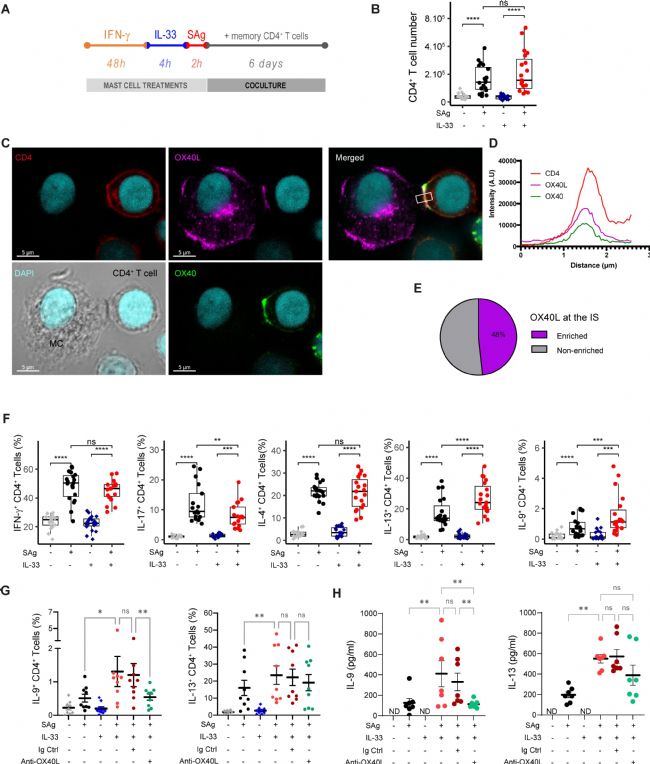 圖3 用 IL-33 誘導的抗原呈遞 MCs 以 OX40L 依賴性方式促進 CD4+ T 細胞中 IL-9 的產生。
圖3 用 IL-33 誘導的抗原呈遞 MCs 以 OX40L 依賴性方式促進 CD4+ T 細胞中 IL-9 的產生。
這項研究表明,IL-33 賦予 MCs 以 OX40L 依賴性方式驅動記憶 CD4+ T 細胞產生 IL-9 和 IL-13 的能力。該研究結果將 MCs 整合到 IL-33 引發的免疫反應中。除了增強 MC 功能和促炎能力外,IL-33 還為 MCs 提供了共刺激分子,其中 OX40L 促進 Th2 細胞產生 IL-13 和 IL-9。同樣,IL-33 介導的 MCs 可以提供浸潤的 Th 細胞產生細胞因子所需的線索,并通過 OX40-OX40L 相互作用提供塑造產生細胞因子組的信號,這里是 IL-9 和 IL-13。
參考文獻:Battut L, Leveque E, Valitutti S, Cenac N, Dietrich G, Espinosa E. IL-33-primed human mast cells drive IL-9 production by CD4+ effector T cells in an OX40L-dependent manner. Front Immunol. 2024 Oct 2;15:1470546. doi: 10.3389/fimmu.2024.1470546. PMID: 39416773; PMCID: PMC11479898.
原文鏈接:https://pubmed.ncbi.nlm.nih.gov/39416773/
Impact Factor 5.7
Electronic ISSN 1664-3224
圖片來源: 所有圖片均來源于參考文獻
小編旨在分享、學習、交流生物科學等領域的研究進展。如有侵權或引文不當請聯系小編修正。如有任何的想法以及建議,歡迎聯系小編。感謝各位的瀏覽以及關注!進入官網www.naturethink.com或關注“Naturethink”公眾號,了解更多相關內容。
點擊了解:細胞共培養