人源化小鼠與新型腫瘤免疫
2021年底,布魯塞爾自由大學(Universite´ Libre de Bruxelles)腫瘤學各研究領域的科學家們發表一篇 Humanized Mice as a Valuable Pre-Clinical Model for Cancer Immunotherapy Research 重要文章,文章中匯總、描述了人源化小鼠在各種腫瘤免疫治療中的應用及臨床預測。指出人源化小鼠能夠同時承受人類免疫系統和人類腫瘤的移植,更好地快速了解“腫瘤-藥物-免疫細胞潛在機制”、藥物動力學和毒性,從而更好地選擇最佳方案用于臨床指導。
新型腫瘤免疫治療在人源化小鼠中的測試應用
免疫檢查點抑制劑(ICI)
Immune checkpoint inhibitors
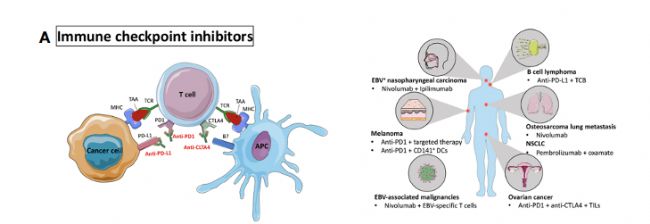
免疫檢查點抑制劑(ICI):阻止抑制受體的參與,激活免疫細胞的抗腫瘤活性。
在人源化小鼠中對ICI進行了靶向EBV+鼻咽癌和其他EBV相關惡性腫瘤,及黑色素瘤、B細胞淋巴瘤、骨肉瘤肺轉移、非小細胞肺癌(NSCLC)和卵巢癌等多種適應癥的驗證。
雙特異性抗體
Bispecific antibodies
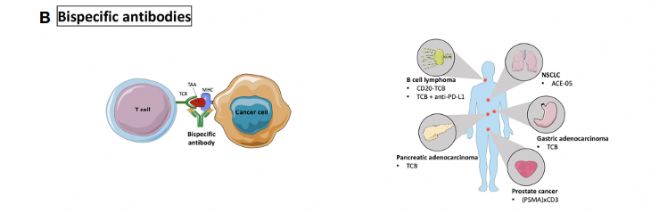
雙特異性抗體:在此主要指T細胞雙特異性抗體(TCB), 可作為一個橋梁,靶向兩種細胞。
在人源小鼠中進行了B細胞淋巴瘤、胰腺癌、NSCLC、胃腺癌和前列腺癌等多種適應癥的驗證。
治療性癌癥疫苗
Therapeutic cancer vaccines
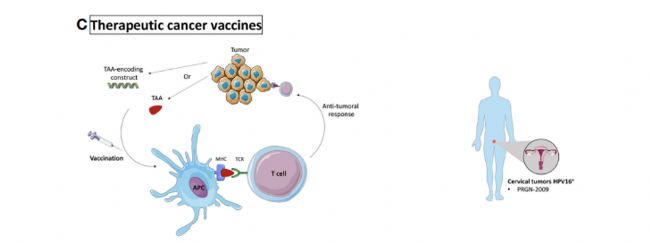
治療性癌癥疫苗:通過向患者注射TAAs或taa編碼產物來增強抗腫瘤活性。
在人源化小鼠中測試了靶向HPV16+的宮頸癌疫苗的抗腫瘤活性。
細胞治療
Adoptive cell transfer

細胞治療:經體外修飾的免疫細胞過繼轉移可提高其抗腫瘤活性。
在人源化小鼠中進行了細胞治療在黑色素瘤、胰腺腺癌、肺癌、卵巢癌和EBV相關惡性腫瘤的測試。
溶瘤病毒
Oncolytic viruses
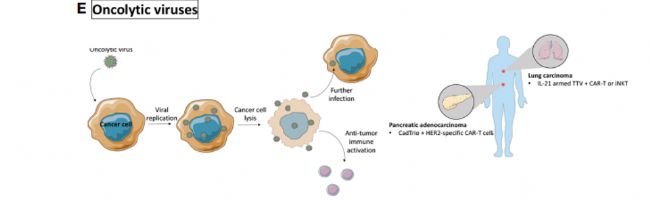
溶瘤病毒: 特異性感染癌癥細胞并誘導腫瘤細胞發生免疫原性細胞死亡。
在人源化小鼠中進行了溶瘤病毒在胰腺癌和肺癌等的測試。

Cogels MM, Rouas R, Ghanem GE, Martinive P, Awada A, Van Gestel D and Krayem M (2021) Humanized Mice as a Valuable Pre-Clinical Model for Cancer Immunotherapy Research. Front. Oncol. 11:784947. doi: 10.3389/fonc.2021.784947
人源化小鼠模型的優化
隨著研究的深入,在涉及到腫瘤免疫治療及聯合療法時,簡單的免疫功能正常小鼠并不是最佳的臨床前模型。因此,一種再現人類免疫-腫瘤相互作用的臨床前模型將是研究中的首選使用模型。
最初的一代NOG/NSG小鼠,實現了免疫系統移植的成功,但不管是在PBMC人源化,還是HSC人源化小鼠中,均有一些局限性:窗口期短,免疫細胞重建單一。
維通利華現有的基于NOG二代的人源化模型:
- huPBMC-NOG-dKO小鼠
- huHSC-NOG-EXL小鼠
這兩個模型使人源化小鼠在臨床前的應用更加具備適用性及臨床預測的準確性:
huPBMC-NOG-dKO
該模型克服了PBMC人源化重建出現Xeno-GVHD的現象,實驗窗口期可長達12周,更有研究表明該模型由于無GVHD反應的發生,更加促進了臨床前藥效評估的準確性。適用于靶點在T細胞上的各種腫瘤免疫治療及聯合療法。
huHSC-NOG-EXL
該模型克服了HSC人源化重建髓系細胞重建不足及重建效率低的問題,更好地重建了人的免疫系統,提高了臨床預測的準確性,且適用于多種免疫細胞參與的差異化腫瘤免疫療法。
了解小鼠人源化模型更多信息,可點擊下方圖片參考文章
維通利華人源化小鼠模型優勢

成品人源化模型已投入使用
維通利華制備的成品新一代人源化模型huPBMC-NOG-dKO及huHSC-NOG-EXL已在國內腫瘤免疫研究中大量使用,使研發者專注于研發創新,提高研發效率。
成品人源化模型細胞來源合規可溯查
采用人源的PBMC及HSC細胞均來自于Charles River(原HemaCare),進口文件齊全。BSL-2實驗室資質,嚴格的生物安全管理操作,無合規風險。
在腫瘤免疫不斷突破的十年中,維通利華人源化小鼠模型不斷改進,研發出了多種在不同的腫瘤免疫研究領域中發揮重要作用的新一代模型。這些模型或可在一些研究領域中延長足夠的窗口期,或可更好地重建人的免疫系統,或更加貼近臨床患者的情況,為醫藥研發提供更準確的臨床前數據支持。
更多人源化小鼠數據信息,應用案例及使用方法可點擊下載下方最新資料。