GOLM1調控肝癌轉移機制研究
癌癥的轉移機制一直是科學家們關注的熱點。來自復旦大學欽倫秀課題組的研究人員發現一個和HCC轉移密切相關的基因——GOLM1。深入的分子機制研究顯示,GOLM1作為一個致癌基因促進了肝癌的生長和轉移,而這個過程是通過選擇性地與表皮生長因子受體EGFR結合,介導EGFR/RTK 錨定到trans-Gogi network上,促進其回收到質膜上而激活下游激酶。該研究為深入理解腫瘤的轉移機制及為轉移開發新的治療方案提供了依據。
研究背景
轉移是腫瘤的一大特征,也是其很難攻克的重要因素之一。已有的研究發現腫瘤的轉移過程由復雜的信號轉導調控網絡控制。生長因子反饋受體激酶(RTKs)在腫瘤的轉移過程中起著重要的調控作用。RTKs的內吞和回收機制,增強了生長因子對有絲分裂的控制,這也是癌細胞的一個顯著性特點。而RTKs的回收和降解過程又是受到高爾基體(Golgi)的控制。Golgi相關的分子是如何具體調控這個過程,又是如何與腫瘤轉移聯系起來,本研究中這個角度出發,為我們詳細解讀了GOLM1在肝癌轉移中的作用角色。
研究思路
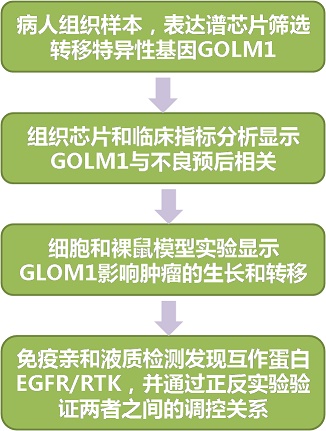
研究結果
1. HCC轉移特異性基因篩選
為了篩選和HCC轉移相關的基因,研究人員利用高通量表達譜芯片,對肝外轉移組織(EHMH),自由轉移肝組織(MFH)和正常肝組織進行了全基因組表達模式差異分析。結果顯示,一個編碼高爾基體相關蛋白GOLPH2的基因——GOLM1,只在EHMH組中特異性顯著上調。由于高爾基體在蛋白合成和轉運中的重要作用,研究人員把GOLM1作為候選研究基因。
通過qRT-PCR和IHC分析,研究人員發現GOLM1的mRNA和蛋白水平在HCC中,特別是EHMHs中顯著增高。早期復發HCCs病人組織中,GOLM1的蛋白水平也明顯高于無復發(RF)病人。因此,GOLM1可能與HCC的轉移密切相關。
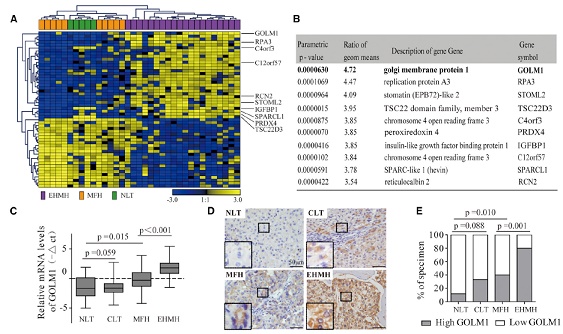
2. GOLM1與HCC病理表征分析
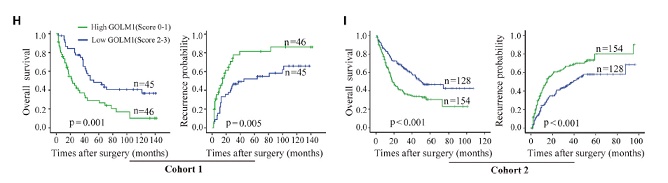
為了進一步探究GOLM1與HCC轉移的關系。研究人員運用組織芯片對375個病人進行了GOLM1表達分析,發現高表達組腫瘤微管侵襲增高,總生存率(OS)低,復發(TTR)時間早。Cox比例風險回歸分析顯示,高表達的GOLM1可作為OS和TTR的獨立診斷指標。因此,GOLM1的過量表達與HCC的不良預后密切相關。
3.GOLM1調控功能分析
首先,對不同HCC細胞系的檢測發現,MHCC-97H,HCC-LM3,Huh-7細胞中GOLM1都是高表達的。同時,這些細胞會伴隨有高的侵襲和轉移能力。在細胞中用shRNAs人為降低GOLM1表達(GOLM1-KD),發現對細胞的增殖能力有一定抑制作用,細胞的轉移和侵襲能力也有所抑制。再將GOLM1 cDNA轉移至GOLM1-KD細胞,可以補救下調抑制表型。在GOLM1低表達細胞系中轉染上調GLOM1(GOLM1FLAG),也能限制增加細胞的增值,侵襲,轉移能力。
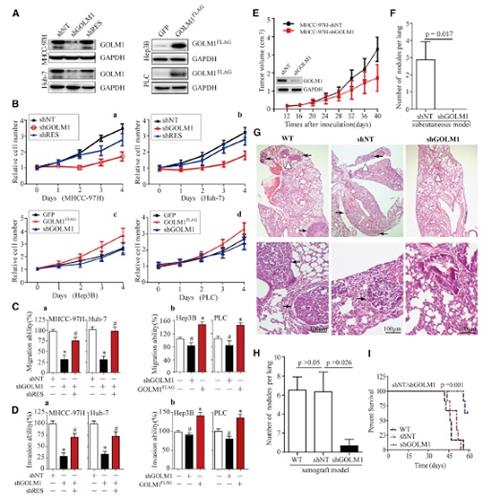
裸鼠皮下移植模型分析顯示,MHCC-97HshGOLM1組腫瘤大小顯著變小,肺轉移也明顯降低。而在小鼠模型中上調GOLM1可顯著增加腫瘤的生長和轉移。因此,內體內外的gain-和loss-of-function實驗表明GOLM1對促進HCC生長和轉移非常重要。
4. GOLM1作用機制分析
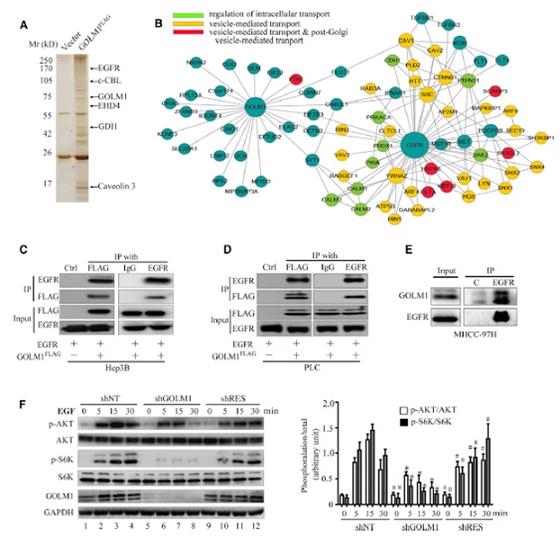
通過免疫親和純化和高通量液質檢測(LC-MS/MS),研究人員發現EGFR蛋白可以與GOLM1結合。在不同細胞中的co-IP實驗也驗證了他們的結合關系。通過對EGFR/RTK下游蛋白檢測也發現,GOLM1-KD可顯著降低MMP9的表達。因此,GLOM1可能通過結合和激活EGFR/RTK信號通路,調控了HCC的生長和轉移。
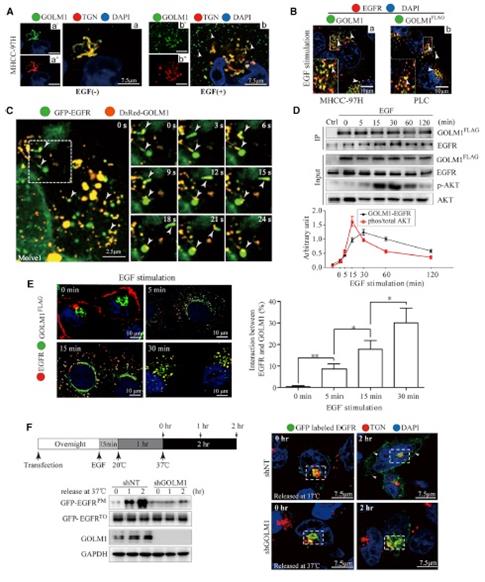
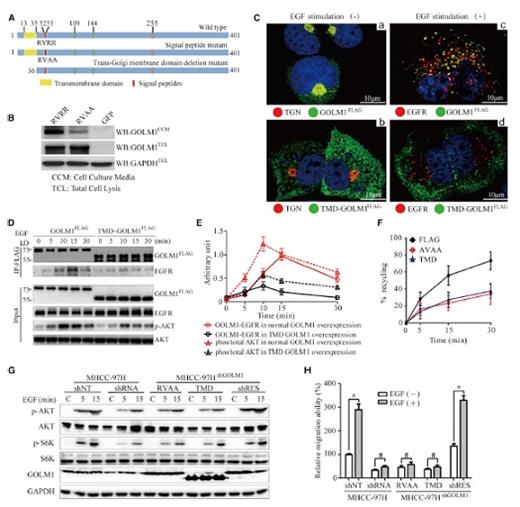
那么,GOLM1和膜蛋白EGFR之間具體是怎么關聯的呢?共聚焦顯微觀察顯示,EGF刺激可影響GLOM1的分布,GLOM1從trans-Golgi network(TGN)轉移到了胞質形成Rab5-positive 囊泡,而和內源EGFR共定位。在肝細胞中可以看到,內化的EGFR會多次和Rab5-positivede GOLM1發生交互作用。定量co-IP和半定量熒光檢測顯示在EGF刺激后,兩者之間最多有15-30 min作用時間。進一步的溫度阻遏和釋放等實驗也顯示,GOLM1-KD會抑制EGFR從TGN到漿膜上。因此,GOLM1可招募EGFR/RTK,進而促進其胞內運輸和下游信號調控而促進HCC生長和轉移。
那么,GOLM1是否影響了EGFR/RTK的內吞和回收過程呢(這對于腫瘤轉移非常重要)?結果顯示,GLOM1-KD可在EGR刺激后增加EGFR的降解,減少EGFR到質膜的回收。那么,HCC轉移是否以此相關?研究人員首先尋找了GOLM1和EGFR/RTK互作的區域,通過一系列的突變構建,發現除了△2–12, △5-12, 和 △13-35都可以和EGFR/RTK結合,點突變G7,R8,R9,M11,K12的GOLM1可以完全抵消掉兩者之間的結合。進一步的GST pull-down實驗也表明GOLM1的胞漿區域(3-12位氨基酸),可直接綁定到EGFR/RTK上去。
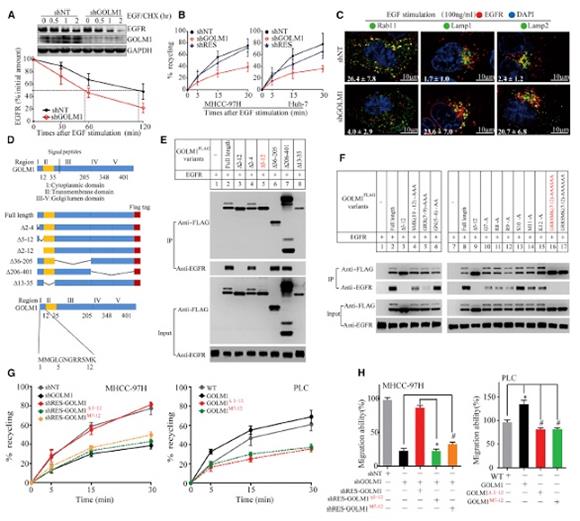
這么這種結合是否影響了EGFR/RTK的回收和細胞遷移呢?在HCC細胞中轉染突變和刪除片段的GOLM1,EGFR/RTK的回收和細胞遷移能力減弱。在PLC細胞中轉染GOLM1,EGFR/RTK的回收和細胞遷移能力增強。因此,正反實驗都顯示,GOLM1影響EGFR/RTK的回收和細胞遷移能力。
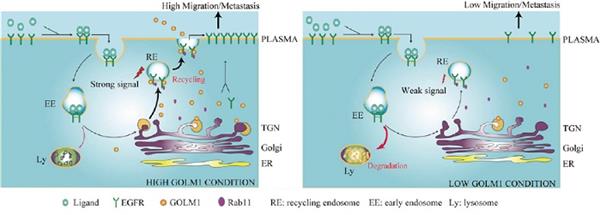
這個過程是否和其他蛋白相關?通過進一步的分析和實驗,研究人員發現GLOM1可招募Rab11和EGFR/RTK形成復合體,返回到細胞表面而駕馭下游信號,影響細胞的侵襲。
通過構建兩個氨基酸突變株(GOLM1-RVAA和GOLM1TMD),研究人員發現GOLM1在PLC細胞中的分泌受到抑制,GOLM1TMD不能與EGFR共定位,EGFR的回收也受到影響。因此,干擾GOLM1的外分泌或高爾基錨定會減少EGFR的回收,進而影響了HCC細胞的遷移。
研究結論
該研究通過前期高通量篩選,找到了和HCC轉移相關基因GOLM1,深入的功能和分子作用機制實驗顯示,GOLM1通過選擇性地與表皮生長因子受體EGFR結合,介導EGFR/RTK 錨定到trans-Gogi network上,促進其回收到質膜上而激活下游激酶,而促進HCC的生長和轉移。該研究為我們深入理解腫瘤的轉移機制提供了新的證據。
該研究由伯豪生物提供服務。
原文出處:
Ye QH, Zhu WW, Zhang JB,et al. GOLM1 Modulates EGFR/RTK Cell-Surface Recycling to Drive Hepatocellular Carcinoma Metastasis. Cancer Cell.2016.