活細胞成像儀應用于細胞凋亡研究實例分享
細胞凋亡實驗常用檢測方法包括細胞形態學鑒定、線粒體膜電位檢測、細胞膜表面磷脂酰絲氨酸(PS)檢測以及凋亡分子標記檢測。以上方法步驟繁瑣,只能觀察最終實驗結果,那么有什么新方法可以彌補這種不足呢?本文將介紹一種新方法——使用活細胞成像分析系統,置于培養箱內實時動態成像,監測細胞變化情況。我們分析了新方法對比常用方法的優勢,同時列舉了幾篇活細胞成像分析系統應用在細胞凋亡方向的高分文章,新方法獲得了科研人員的認可,在細胞凋亡實驗中被廣泛使用。
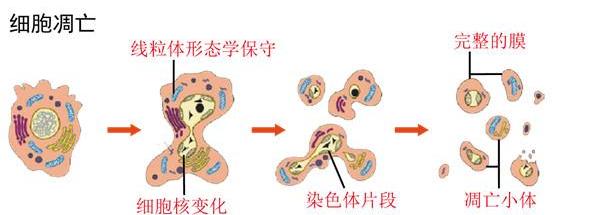
細胞死亡是最重要的生物進程之一。當機體存在衰老或損傷細胞需要清除,細胞死亡便作為第一步發揮作用。根據機制不同,細胞死亡可分為細胞凋亡(Apoptosis)、自噬、壞死或壞死性凋亡。細胞凋亡,或者說程序性細胞死亡(Programmed cell death),刺激因素多源自細胞內部。凋亡過程中細胞形態發生變化(圖1),在細胞凋亡早期,細胞體積縮小,細胞膜脫落,染色質凝聚,細胞器解體。在細胞凋亡晚期,細胞膜破裂,細胞產生毒性物質等,形成凋亡小體。
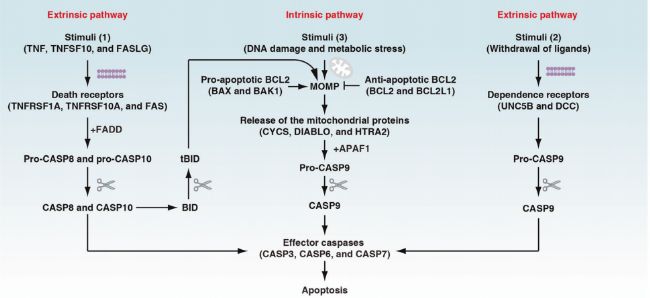
細胞凋亡可由內在途徑或外在途徑誘導(圖2)。內在途徑起源于線粒體,線粒體通過釋放細胞色素C誘導Caspase級聯反應。Caspase能夠降解胞內蛋白質,最終導致細胞死亡。外在途徑依賴于胞外信號通路,如TNF、FAS。這些分子與TNF受體家族結合,形成死亡誘導信號復合體(DISC)。最后內在和外在途徑共同引起蛋白水解酶Caspase-3的激活,導致細胞的死亡。
細胞凋亡在癌癥和神經疾病研究領域尤為重要。在幾種神經系統疾病中,不必要的神經細胞凋亡會導致生命危險;另一方面,選擇性地誘導神經細胞凋亡也是一種有效的疾病治療方法。了解細胞凋亡背后的機制有助于預防疾病導致的神經元損傷,并能找到更好的抗癌策略。
目前檢測細胞凋亡的方法主要有顯微鏡觀察法、線粒體膜電位檢測、細胞膜表面磷脂酰絲氨酸(PS)檢測以及凋亡分子標記檢測。
1. 顯微鏡觀察法
凋亡過程中細胞形態發生變化,可對細胞核進行熒光染色后在熒光顯微鏡下進行細胞形態觀察。
2. 線粒體膜電位(Δψm)檢測:
細胞凋亡過程中涉及線粒體膜電位的變化。跨膜電位下降被認為是細胞凋亡級聯反應過程中早發生的事件,出現在細胞核凋亡特征(染色質濃縮、DNA 斷裂)之前。使用JC-1或TMRM染料,通過流式細胞分析或熒光成像檢測線粒體膜電位差。
3. 細胞膜表面磷脂酰絲氨酸(PS)檢測:
Annexin V是膜聯蛋白組的一個成員,如果PS翻轉到膜的外側,Annexin V就會與質膜中的PS發生高親和力結合。將 Annexin V與PI相結合可以確定細胞凋亡所處的階段。由于PI只能標記染色質膜受損的細胞核,因此只有Annexin V陽性的細胞代表早期凋亡,只有PI陽性的細胞代表壞死,而Annexin V-PI雙陽性則是晚期凋亡的標志。
4. 凋亡分子標記檢測:
Caspase-3在細胞凋亡中起著不可替代的作用,上游的凋亡信號通過切割Caspase-3使其具備酶活性,執行最后的凋亡程序,在凋亡晚期,Caspase-3酶活性降低。實驗者可以通過Western blot對Caspase-3進行定量分析,或者借助檢測試劑盒測定Caspase-3活性。
上述常見的細胞凋亡檢測方法,需頻繁將細胞拿出培養箱,操作繁瑣,且只能得到最終實驗結果,無法查看細胞凋亡完整過程,且個別試劑會對細胞結構造成影響。耗時、耗力、實驗成功率不能保證,最終影響實驗效率。
那么,使用什么樣的工具可以改善這些問題呢?
奎克泰生物的JuLI™系列實時活細胞成像分析儀能夠放置于培養箱內,對細胞實時觀察、拍攝記錄生長周期的全過程,在保持細胞生長環境穩定的情況下,同時對細胞計數、拍照,形成視頻、融合度、生長曲線,提供細胞凋亡過程視頻和量化結果。此外,JuLI™ Stage活細胞成像分析系統具有全自動X-Y-Z軸、三色熒光、自動/手動對焦、Z-Stack、圖像拼接等功能,實現細胞凋亡過程中的實時監測和無損成像,通過明場/熒光細胞圖像,基于圖像分析軟件,鑒定細胞形態特征。

研究者可以預先設定好拍攝參數,通過延時攝影監測并評估細胞凋亡情況,提供細胞凋亡量化結果。
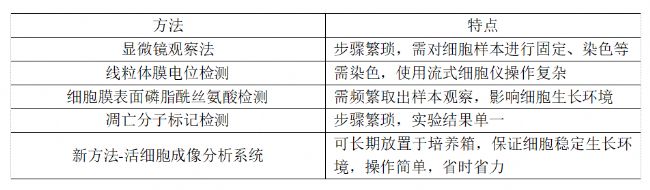
對比常規細胞凋亡檢測方法,活細胞成像分析系統大大縮減了人工操作的繁瑣性、提高了實驗結果的準確性、成功率,省時省力,為研究人員帶來了便利。
以下來自世界各地知名機構發布的3篇文章,均為使用JuLI™系列活細胞成像分析系統做的細胞凋亡實驗。
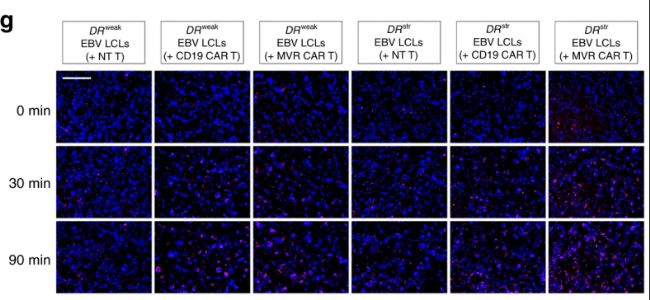
1. 來自韓國國立癌癥中心免疫治療科的研究人員在《Nature Communications》發表題為“Desensitized chimeric antigen receptor T cells selectively recognize target cells with enhanced antigen expression”的文章[2],研究人員應用了細胞凋亡試劑盒,使用JuLI™ Stage測定EBV LCLs細胞凋亡動力學。研究表明CD19 CAR T和MVR CAR T細胞逐漸增加了EBV LCLs細胞凋亡比例。每5min拍攝一次DAPI和RFP熒光圖像,持續記錄90min。
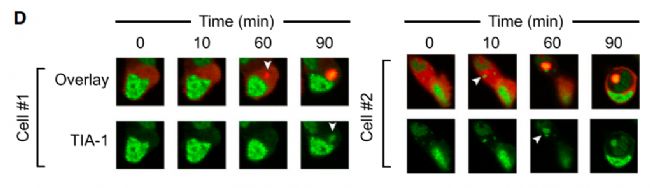
2. 來自墨爾本大學Bio21分子科學與生物技術研究所的研究人員在《Cell Reports》發表題為“Huntingtin Inclusions Trigger Cellular Quiescence, Deactivate Apoptosis, and Lead to Delayed Necrosis”的文章[3],研究人員通過GFP-tagged prion domain protein TIA-1和 Httex1(97Q)-Cherry共轉染,使用JuLI™ Stage拍攝圖像,共記錄90min。結果表明在Httex1包涵體形成后,TIA-1進入到Httex1包涵體中。
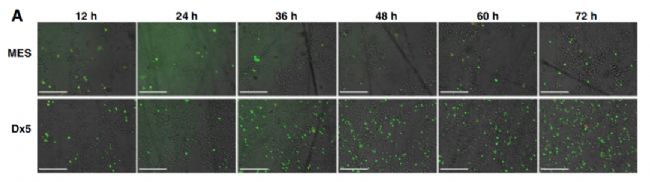
3. 來自匈牙利科學院自然科學研究中心酶學研究所的研究人員在《Molecular Cancer Therapeutics》發表題為“Identification and Validation of Compounds Selectively Killing Resistant Cancer:Delineating Cell Line-Specific Effects from P-Glycoprotein-Induced Toxicity”的文章[4],研究者應用FITC細胞凋亡檢測試劑盒,使用JuLI™ Stage實時熒光檢測功能拍攝圖像,根據圖像熒光強度判斷細胞凋亡狀態。
細胞死亡是最重要的生物進程之一。當機體存在衰老或損傷細胞需要清除,細胞死亡便作為第一步發揮作用。根據機制不同,細胞死亡可分為細胞凋亡(Apoptosis)、自噬、壞死或壞死性凋亡。細胞凋亡,或者說程序性細胞死亡(Programmed cell death),刺激因素多源自細胞內部。凋亡過程中細胞形態發生變化(圖1),在細胞凋亡早期,細胞體積縮小,細胞膜脫落,染色質凝聚,細胞器解體。在細胞凋亡晚期,細胞膜破裂,細胞產生毒性物質等,形成凋亡小體。

細胞凋亡形態變化圖
細胞凋亡可由內在途徑或外在途徑誘導(圖2)。內在途徑起源于線粒體,線粒體通過釋放細胞色素C誘導Caspase級聯反應。Caspase能夠降解胞內蛋白質,最終導致細胞死亡。外在途徑依賴于胞外信號通路,如TNF、FAS。這些分子與TNF受體家族結合,形成死亡誘導信號復合體(DISC)。最后內在和外在途徑共同引起蛋白水解酶Caspase-3的激活,導致細胞的死亡。

細胞凋亡的內在和外在信號通路
細胞凋亡在癌癥和神經疾病研究領域尤為重要。在幾種神經系統疾病中,不必要的神經細胞凋亡會導致生命危險;另一方面,選擇性地誘導神經細胞凋亡也是一種有效的疾病治療方法。了解細胞凋亡背后的機制有助于預防疾病導致的神經元損傷,并能找到更好的抗癌策略。
目前檢測細胞凋亡的方法主要有顯微鏡觀察法、線粒體膜電位檢測、細胞膜表面磷脂酰絲氨酸(PS)檢測以及凋亡分子標記檢測。
1. 顯微鏡觀察法
凋亡過程中細胞形態發生變化,可對細胞核進行熒光染色后在熒光顯微鏡下進行細胞形態觀察。
2. 線粒體膜電位(Δψm)檢測:
細胞凋亡過程中涉及線粒體膜電位的變化。跨膜電位下降被認為是細胞凋亡級聯反應過程中早發生的事件,出現在細胞核凋亡特征(染色質濃縮、DNA 斷裂)之前。使用JC-1或TMRM染料,通過流式細胞分析或熒光成像檢測線粒體膜電位差。
3. 細胞膜表面磷脂酰絲氨酸(PS)檢測:
Annexin V是膜聯蛋白組的一個成員,如果PS翻轉到膜的外側,Annexin V就會與質膜中的PS發生高親和力結合。將 Annexin V與PI相結合可以確定細胞凋亡所處的階段。由于PI只能標記染色質膜受損的細胞核,因此只有Annexin V陽性的細胞代表早期凋亡,只有PI陽性的細胞代表壞死,而Annexin V-PI雙陽性則是晚期凋亡的標志。
4. 凋亡分子標記檢測:
Caspase-3在細胞凋亡中起著不可替代的作用,上游的凋亡信號通過切割Caspase-3使其具備酶活性,執行最后的凋亡程序,在凋亡晚期,Caspase-3酶活性降低。實驗者可以通過Western blot對Caspase-3進行定量分析,或者借助檢測試劑盒測定Caspase-3活性。
上述常見的細胞凋亡檢測方法,需頻繁將細胞拿出培養箱,操作繁瑣,且只能得到最終實驗結果,無法查看細胞凋亡完整過程,且個別試劑會對細胞結構造成影響。耗時、耗力、實驗成功率不能保證,最終影響實驗效率。
那么,使用什么樣的工具可以改善這些問題呢?
奎克泰生物的JuLI™系列實時活細胞成像分析儀能夠放置于培養箱內,對細胞實時觀察、拍攝記錄生長周期的全過程,在保持細胞生長環境穩定的情況下,同時對細胞計數、拍照,形成視頻、融合度、生長曲線,提供細胞凋亡過程視頻和量化結果。此外,JuLI™ Stage活細胞成像分析系統具有全自動X-Y-Z軸、三色熒光、自動/手動對焦、Z-Stack、圖像拼接等功能,實現細胞凋亡過程中的實時監測和無損成像,通過明場/熒光細胞圖像,基于圖像分析軟件,鑒定細胞形態特征。

JuLI™系列放置于培養箱中
研究者可以預先設定好拍攝參數,通過延時攝影監測并評估細胞凋亡情況,提供細胞凋亡量化結果。

對比常規細胞凋亡檢測方法,活細胞成像分析系統大大縮減了人工操作的繁瑣性、提高了實驗結果的準確性、成功率,省時省力,為研究人員帶來了便利。
以下來自世界各地知名機構發布的3篇文章,均為使用JuLI™系列活細胞成像分析系統做的細胞凋亡實驗。
1. 來自韓國國立癌癥中心免疫治療科的研究人員在《Nature Communications》發表題為“Desensitized chimeric antigen receptor T cells selectively recognize target cells with enhanced antigen expression”的文章[2],研究人員應用了細胞凋亡試劑盒,使用JuLI™ Stage測定EBV LCLs細胞凋亡動力學。研究表明CD19 CAR T和MVR CAR T細胞逐漸增加了EBV LCLs細胞凋亡比例。每5min拍攝一次DAPI和RFP熒光圖像,持續記錄90min。

EBV LCLs細胞凋亡檢測結果圖
2. 來自墨爾本大學Bio21分子科學與生物技術研究所的研究人員在《Cell Reports》發表題為“Huntingtin Inclusions Trigger Cellular Quiescence, Deactivate Apoptosis, and Lead to Delayed Necrosis”的文章[3],研究人員通過GFP-tagged prion domain protein TIA-1和 Httex1(97Q)-Cherry共轉染,使用JuLI™ Stage拍攝圖像,共記錄90min。結果表明在Httex1包涵體形成后,TIA-1進入到Httex1包涵體中。

GFP標記的TIA-1進入Httex1包涵體(紅色)結果圖
3. 來自匈牙利科學院自然科學研究中心酶學研究所的研究人員在《Molecular Cancer Therapeutics》發表題為“Identification and Validation of Compounds Selectively Killing Resistant Cancer:Delineating Cell Line-Specific Effects from P-Glycoprotein-Induced Toxicity”的文章[4],研究者應用FITC細胞凋亡檢測試劑盒,使用JuLI™ Stage實時熒光檢測功能拍攝圖像,根據圖像熒光強度判斷細胞凋亡狀態。

NSC57969選擇性地誘導細胞凋亡結果圖
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com