剪切應力對動脈粥樣硬化血管內皮功能的影響及潛在的治療方法
動脈中的不同血流模式可以改變血管內皮細胞(ECs)的適應性表型,從而影響ECs的功能,并與動脈粥樣硬化(AS)早期病變的發生直接相關(圖1)。
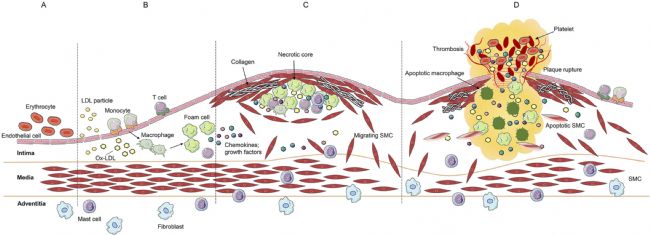 圖1 動脈粥樣硬化進展的階段。(A)這部分圖片為正常動脈結構。(B)這部分圖片是動脈粥樣硬化的初始階段,包括低密度脂蛋白(LDL)進入內膜,血液中單核細胞和T細胞粘附并遷移到內膜,攝取氧化型低密度脂蛋白(ox-LDL)生成泡沫細胞。(C)病變的進展包括活化的內皮細胞和巨噬細胞分泌的趨化因子和生長因子,誘導平滑肌細胞遷移到內膜,逐漸形成含有壞死核心的纖維帽結構。(D)病變晚期斑塊逐漸增大,細胞外基質成分蛋白水解導致斑塊不穩定,最終破裂形成血栓。
圖1 動脈粥樣硬化進展的階段。(A)這部分圖片為正常動脈結構。(B)這部分圖片是動脈粥樣硬化的初始階段,包括低密度脂蛋白(LDL)進入內膜,血液中單核細胞和T細胞粘附并遷移到內膜,攝取氧化型低密度脂蛋白(ox-LDL)生成泡沫細胞。(C)病變的進展包括活化的內皮細胞和巨噬細胞分泌的趨化因子和生長因子,誘導平滑肌細胞遷移到內膜,逐漸形成含有壞死核心的纖維帽結構。(D)病變晚期斑塊逐漸增大,細胞外基質成分蛋白水解導致斑塊不穩定,最終破裂形成血栓。
動脈粥樣硬化斑塊常見于彎曲或分叉的動脈,其中血流模式以振蕩剪切應力(OSS)為主。OSS可誘導ECs轉化為促炎表型,增加細胞炎癥、氧化應激反應、線粒體功能障礙、代謝異常和內皮通透性,從而促進AS的進展。另一方面,直段動脈具有穩定的層狀剪切應力(LSS),其促進ECs轉化為抗炎表型,改善內皮細胞功能,從而抑制動脈粥樣硬化進展。ECs具有通過剪切應力主動感知,整合和轉換機械刺激為生化信號的能力,從而進一步誘導細胞內變化(例如離子通道的打開和關閉,信號通路的激活和轉錄)(圖2)。
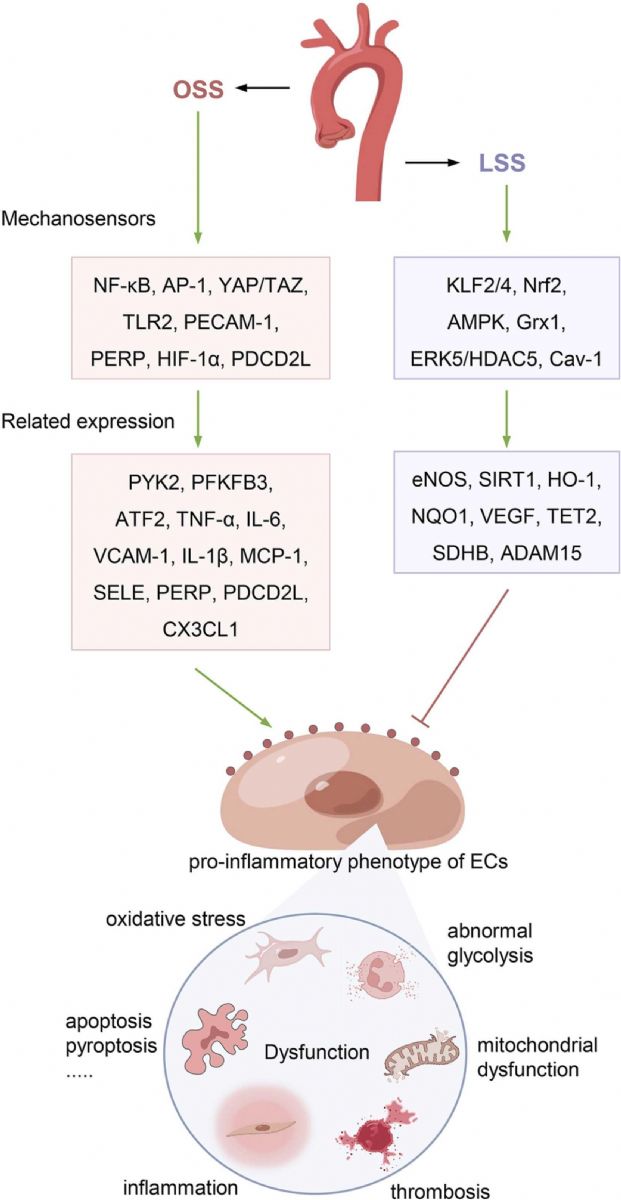 圖2 剪切應力對血管不同部位內皮細胞功能的影響。該圖像顯示了主動脈中的血流模式。內皮細胞(ECs)中的機械傳感器或敏感因子受OSS和LSS調控,進一步誘導ECs中相關基因的表達,從而影響內皮細胞功能。綠色箭頭表示激活,紅色箭頭表示抑制。
圖2 剪切應力對血管不同部位內皮細胞功能的影響。該圖像顯示了主動脈中的血流模式。內皮細胞(ECs)中的機械傳感器或敏感因子受OSS和LSS調控,進一步誘導ECs中相關基因的表達,從而影響內皮細胞功能。綠色箭頭表示激活,紅色箭頭表示抑制。
ECs通過細胞機械轉導途徑實現一系列響應剪切應力的適應性變化。直接感知血流動力學的細胞膜、細胞附著位點和細胞骨架網絡被認為是主要的機械傳感器。這些機械傳感器包括離子通道、細胞-細胞連接復合物、細胞骨架相關復合物和細胞膜表面結構,他們形成一個互連的網絡,將機械信號從細胞外環境傳輸到細胞進行響應,并執行復雜的過程,如遷移和粘附。這表明這些亞細胞微區或轉錄因子可能在剪切應力對AS發展的影響中發揮作用。
因此,四川大學華西醫院康復醫學中心、四川大學華西醫院國家老年病學臨床研究中心的研究團隊在國際期刊 Biomedicine & Pharmacotherapy 發表題為“Effects of shear stress on vascular endothelial functions in atherosclerosis and potential therapeutic approaches” 的長文綜述。全面闡述了血管ECs功能與AS血流流體剪切應力變化的關系,并介紹了針對特定機械轉導的潛在治療方法。研究有助于我們探索動脈粥樣硬化性血管疾病特異性治療的新策略。

文章首先描述了內皮機械傳感器在剪切應力響應中的作用,如小窩具有防止細胞損傷和調節細胞膜張力的作用;初級纖毛是剪切應力環境中細胞內鈣和一氧化氮信號的開關;離子通道介導剪切應力誘導的Ca2+內流或血管舒張;連接蛋白促進血管穩定性,調節血管通透性和細胞間通訊;糖萼調節內皮細胞功能和抗氧化等。
然后總結了剪切應力和幾種相關信號通路,如eNOS 信號通路、KLF2 信號通路和Nrf2 信號通路。研究發現LSS可以通過多種途徑激活eNOS,從而達到抗動脈粥樣硬化的作用,而且LSS對eNOS活性有相反的作用,因此,eNOS作為治療靶點是抑制AS進展的最佳方法。對于KLF2 信號通路,LSS以KLF2依賴的方式調節ECs的代謝,相反,OSS負調節KLF2表達,而且許多抗動脈粥樣硬化藥物通過激活KLF2的表達發揮作用。Nrf2也是KLF2的靶標,它與KLF2一起控制一些LSS誘導的基因。有趣的是,Nrf2在體內表現出促動脈粥樣硬化和抗動脈粥樣硬化作用,實驗結果表明,Nrf2對小鼠AS的進展是積極還是消極的影響似乎也與遺傳背景有關。然而,在基因工程小鼠中觀察到的這些結果尚未得到臨床研究,并且尚不清楚Nrf2在AS患者的治療中是否具有雙重作用。
接下來,文章分述了剪切應力和線粒體穩態、內皮炎癥、內皮細胞程序性細胞死亡(PCD)、內皮細胞通透性、內皮細胞和其他細胞之間的串擾的關系。在整個動脈粥樣硬化疾病過程中,有兩種主要類型的細胞與內皮細胞密切相關:單核細胞和血管平滑肌細胞。因此,研究關注了剪切應力對內皮細胞與這兩種細胞相互作用的影響(圖3)。簡言之,剪切應力調節單核細胞對 ECs 的粘附,還可以調節內皮功能障礙后血管平滑肌細胞的表型。
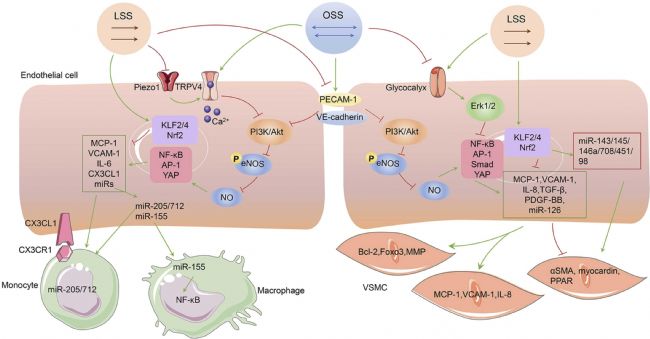 圖3 剪切應力在調節ECs與其他細胞之間的串擾中的作用。示意圖顯示了LSS和OSS在ECs與其他細胞通信中的不同作用。在單核細胞通訊中,OSS通過增加PECAM-1和CX3CL1的表達,激活離子通道Piezo1和TRPV4通道,促進miR205/712的釋放,促進單核細胞粘附。它還同時上調miR-155以激活巨噬細胞的促炎表型。LSS抑制這些促進單核細胞粘附的因子,以減少粘附并改善內皮屏障功能。在血管平滑肌細胞中,OSS 降低 VSMC 收縮特異性基因(例如 α-SMA)并誘導 VSMC 炎癥和凋亡(例如 VCAM-1、IL-8、Bcl2)。LSS通過KLF2、miR-143/145/146a/708/451/98等降低VSMCs遷移和增殖激活因子的表達,從而建立靜態VSMCs表型。綠色箭頭表示激活,紅色箭頭表示抑制。
圖3 剪切應力在調節ECs與其他細胞之間的串擾中的作用。示意圖顯示了LSS和OSS在ECs與其他細胞通信中的不同作用。在單核細胞通訊中,OSS通過增加PECAM-1和CX3CL1的表達,激活離子通道Piezo1和TRPV4通道,促進miR205/712的釋放,促進單核細胞粘附。它還同時上調miR-155以激活巨噬細胞的促炎表型。LSS抑制這些促進單核細胞粘附的因子,以減少粘附并改善內皮屏障功能。在血管平滑肌細胞中,OSS 降低 VSMC 收縮特異性基因(例如 α-SMA)并誘導 VSMC 炎癥和凋亡(例如 VCAM-1、IL-8、Bcl2)。LSS通過KLF2、miR-143/145/146a/708/451/98等降低VSMCs遷移和增殖激活因子的表達,從而建立靜態VSMCs表型。綠色箭頭表示激活,紅色箭頭表示抑制。
最后,研究人員重點分析了與剪切應力相關的潛在動脈粥樣硬化的治療策略,包括藥物治療、基因治療、康復治療和手術治療。
許多藥物可用作KLF2和/或KLF4的激活劑來治療AS,例如他汀類藥物,白藜蘆醇和單寧酸(TA)。如他汀類藥物通過異戊二烯代謝或肌細胞增強因子-2(MEF2)通路激活KLF2/KLF4。此外,他汀類藥物還可以激活Nrf2通路以達到治療目的。白藜蘆醇可以通過SIRT1/MAP/ERK激酶5(MEK5)/MEF2和AMPKα/ERK5/MEF2來激活KLF2,也可以通過MEK5/MEF2途徑激活KLF4。TA通過ERK5/MEF2途徑激活KLF2,從而減少單核細胞粘附,并對小鼠體內AS具有保護作用。蘿卜硫素是西蘭花中的天然產物,以KLF2依賴性方式激活Nrf2,并減少ECs的促炎表型。BMS-06和長春西汀通過抑制NF-κB來減緩炎癥和AS。但這種系統性情況需要仔細評估潛在的副作用。
一些新的研究集中在剪切應力相關基因治療在AS中的作用。研究人員研究了剪切應力對炎癥條件下ECs和VSMCs中前蛋白轉換酶枯草桿菌蛋白酶/kexin 9(PCSK9)表達的影響,即低OSS區域具有較高的PCSK9表達。通過靶向PCSK9單克隆抗體,功能喪失或siRNA介導的基因沉默來破壞PCSK189活性可顯著降低AS的風險。此外,載脂蛋白C3(APOC3)的過表達將加速VSMC的增殖并導致AS的進展。過氧化物酶體增殖物激活受體(PPAR)與AS代謝紊亂有關。長鏈非編碼RNAs(LncRNAs)參與動脈粥樣硬化斑塊的形成,因此是治療的潛在靶點,更多的miRNAs已被證明參與剪切應力背景下內皮細胞功能的調節。可以發現,各種治療方式之間似乎在表觀遺傳學上存在聯系,我們可以找到一種更全面的治療方法促進治療策略的發展。
運動訓練對血管系統的影響已得到充分研究,與動脈剪切應力和機械轉導有關。運動會增加LSS并減少氧化應激。即使血壓、血脂水平和糖耐量等與AS相關的危險因素未得到改善,運動也能改善血管功能。在體外實驗中,研究人員發現很難使用單一類型的剪切應力來充分反映運動的效果,因為運動的效果似乎與動脈的位置、訓練強度、持續時間等有關。此外,還應考慮體外剪切應力的位置、振幅、方向和頻率。因此,很難將運動誘導的內皮細胞變化直接聯系到體內。而且,一些研究還表明,運動可能具有雙重作用,即高容量、高強度的訓練會促進動脈斑塊的形成,增加AS,而這種可能性在有心血管疾病危險因素的人群中可能會增加。未來的研究可以繼續關注這些方面。如果能通過無創治療改善AS患者的病情,也有可能提高患者的舒適度,有利于后續康復。
當動脈粥樣硬化進展為難治性癥狀或并發癥時,臨床上將考慮經導管主動脈瓣植入術、冠狀動脈支架植入術或冠狀動脈旁路移植術,以改善患者結局并延長患者壽命。手術治療可以在一定程度上改變體內的血液流動。然而,這種變化是否與植入體的形狀、尺寸和材料有關,尚無系統的研究。
綜上所述,可以發現,無論是體內還是體外研究,血流模式和相應的剪切應力模式不僅可以調節血管內皮細胞的基因表達和細胞表型,還可以影響參與AS進展的外周細胞。簡而言之,基于相應的剪切應力機制(例如特定的機械傳感器和信號通路)的AS新治療策略正在出現。它為AS的治療提供了新的解決方案,在臨床前研究和臨床試驗中顯示出潛在的療效。此外,AS進展中機械信號通路的轉導和調控對于靶向治療的確定也非常重要。該綜述將有助于探索和應用新的治療策略,最終指出AS未來的研究方向。
參考文獻:Cheng H, Zhong W, Wang L, Zhang Q, Ma X, Wang Y, Wang S, He C, Wei Q, Fu C. Effects of shear stress on vascular endothelial functions in atherosclerosis and potential therapeutic approaches. Biomed Pharmacother. 2023 Feb;158:114198. doi: 10.1016/j.biopha.2022.114198. Epub 2023 Jan 3. PMID: 36916427.
原文鏈接:https://pubmed.ncbi.nlm.nih.gov/36916427/
Impact Factor 7.5
Online ISSN: 1950-6007
Print ISSN: 0753-3322
小編旨在分享、學習、交流生物科學等域的研究進展。如有侵權或引文不當請聯系小編修正。
微信搜索公眾號“Naturethink”,了解更多細胞體外仿生培養技術及應用。

動脈粥樣硬化斑塊常見于彎曲或分叉的動脈,其中血流模式以振蕩剪切應力(OSS)為主。OSS可誘導ECs轉化為促炎表型,增加細胞炎癥、氧化應激反應、線粒體功能障礙、代謝異常和內皮通透性,從而促進AS的進展。另一方面,直段動脈具有穩定的層狀剪切應力(LSS),其促進ECs轉化為抗炎表型,改善內皮細胞功能,從而抑制動脈粥樣硬化進展。ECs具有通過剪切應力主動感知,整合和轉換機械刺激為生化信號的能力,從而進一步誘導細胞內變化(例如離子通道的打開和關閉,信號通路的激活和轉錄)(圖2)。

ECs通過細胞機械轉導途徑實現一系列響應剪切應力的適應性變化。直接感知血流動力學的細胞膜、細胞附著位點和細胞骨架網絡被認為是主要的機械傳感器。這些機械傳感器包括離子通道、細胞-細胞連接復合物、細胞骨架相關復合物和細胞膜表面結構,他們形成一個互連的網絡,將機械信號從細胞外環境傳輸到細胞進行響應,并執行復雜的過程,如遷移和粘附。這表明這些亞細胞微區或轉錄因子可能在剪切應力對AS發展的影響中發揮作用。
因此,四川大學華西醫院康復醫學中心、四川大學華西醫院國家老年病學臨床研究中心的研究團隊在國際期刊 Biomedicine & Pharmacotherapy 發表題為“Effects of shear stress on vascular endothelial functions in atherosclerosis and potential therapeutic approaches” 的長文綜述。全面闡述了血管ECs功能與AS血流流體剪切應力變化的關系,并介紹了針對特定機械轉導的潛在治療方法。研究有助于我們探索動脈粥樣硬化性血管疾病特異性治療的新策略。

文章首先描述了內皮機械傳感器在剪切應力響應中的作用,如小窩具有防止細胞損傷和調節細胞膜張力的作用;初級纖毛是剪切應力環境中細胞內鈣和一氧化氮信號的開關;離子通道介導剪切應力誘導的Ca2+內流或血管舒張;連接蛋白促進血管穩定性,調節血管通透性和細胞間通訊;糖萼調節內皮細胞功能和抗氧化等。
然后總結了剪切應力和幾種相關信號通路,如eNOS 信號通路、KLF2 信號通路和Nrf2 信號通路。研究發現LSS可以通過多種途徑激活eNOS,從而達到抗動脈粥樣硬化的作用,而且LSS對eNOS活性有相反的作用,因此,eNOS作為治療靶點是抑制AS進展的最佳方法。對于KLF2 信號通路,LSS以KLF2依賴的方式調節ECs的代謝,相反,OSS負調節KLF2表達,而且許多抗動脈粥樣硬化藥物通過激活KLF2的表達發揮作用。Nrf2也是KLF2的靶標,它與KLF2一起控制一些LSS誘導的基因。有趣的是,Nrf2在體內表現出促動脈粥樣硬化和抗動脈粥樣硬化作用,實驗結果表明,Nrf2對小鼠AS的進展是積極還是消極的影響似乎也與遺傳背景有關。然而,在基因工程小鼠中觀察到的這些結果尚未得到臨床研究,并且尚不清楚Nrf2在AS患者的治療中是否具有雙重作用。
接下來,文章分述了剪切應力和線粒體穩態、內皮炎癥、內皮細胞程序性細胞死亡(PCD)、內皮細胞通透性、內皮細胞和其他細胞之間的串擾的關系。在整個動脈粥樣硬化疾病過程中,有兩種主要類型的細胞與內皮細胞密切相關:單核細胞和血管平滑肌細胞。因此,研究關注了剪切應力對內皮細胞與這兩種細胞相互作用的影響(圖3)。簡言之,剪切應力調節單核細胞對 ECs 的粘附,還可以調節內皮功能障礙后血管平滑肌細胞的表型。

最后,研究人員重點分析了與剪切應力相關的潛在動脈粥樣硬化的治療策略,包括藥物治療、基因治療、康復治療和手術治療。
許多藥物可用作KLF2和/或KLF4的激活劑來治療AS,例如他汀類藥物,白藜蘆醇和單寧酸(TA)。如他汀類藥物通過異戊二烯代謝或肌細胞增強因子-2(MEF2)通路激活KLF2/KLF4。此外,他汀類藥物還可以激活Nrf2通路以達到治療目的。白藜蘆醇可以通過SIRT1/MAP/ERK激酶5(MEK5)/MEF2和AMPKα/ERK5/MEF2來激活KLF2,也可以通過MEK5/MEF2途徑激活KLF4。TA通過ERK5/MEF2途徑激活KLF2,從而減少單核細胞粘附,并對小鼠體內AS具有保護作用。蘿卜硫素是西蘭花中的天然產物,以KLF2依賴性方式激活Nrf2,并減少ECs的促炎表型。BMS-06和長春西汀通過抑制NF-κB來減緩炎癥和AS。但這種系統性情況需要仔細評估潛在的副作用。
一些新的研究集中在剪切應力相關基因治療在AS中的作用。研究人員研究了剪切應力對炎癥條件下ECs和VSMCs中前蛋白轉換酶枯草桿菌蛋白酶/kexin 9(PCSK9)表達的影響,即低OSS區域具有較高的PCSK9表達。通過靶向PCSK9單克隆抗體,功能喪失或siRNA介導的基因沉默來破壞PCSK189活性可顯著降低AS的風險。此外,載脂蛋白C3(APOC3)的過表達將加速VSMC的增殖并導致AS的進展。過氧化物酶體增殖物激活受體(PPAR)與AS代謝紊亂有關。長鏈非編碼RNAs(LncRNAs)參與動脈粥樣硬化斑塊的形成,因此是治療的潛在靶點,更多的miRNAs已被證明參與剪切應力背景下內皮細胞功能的調節。可以發現,各種治療方式之間似乎在表觀遺傳學上存在聯系,我們可以找到一種更全面的治療方法促進治療策略的發展。
運動訓練對血管系統的影響已得到充分研究,與動脈剪切應力和機械轉導有關。運動會增加LSS并減少氧化應激。即使血壓、血脂水平和糖耐量等與AS相關的危險因素未得到改善,運動也能改善血管功能。在體外實驗中,研究人員發現很難使用單一類型的剪切應力來充分反映運動的效果,因為運動的效果似乎與動脈的位置、訓練強度、持續時間等有關。此外,還應考慮體外剪切應力的位置、振幅、方向和頻率。因此,很難將運動誘導的內皮細胞變化直接聯系到體內。而且,一些研究還表明,運動可能具有雙重作用,即高容量、高強度的訓練會促進動脈斑塊的形成,增加AS,而這種可能性在有心血管疾病危險因素的人群中可能會增加。未來的研究可以繼續關注這些方面。如果能通過無創治療改善AS患者的病情,也有可能提高患者的舒適度,有利于后續康復。
當動脈粥樣硬化進展為難治性癥狀或并發癥時,臨床上將考慮經導管主動脈瓣植入術、冠狀動脈支架植入術或冠狀動脈旁路移植術,以改善患者結局并延長患者壽命。手術治療可以在一定程度上改變體內的血液流動。然而,這種變化是否與植入體的形狀、尺寸和材料有關,尚無系統的研究。
綜上所述,可以發現,無論是體內還是體外研究,血流模式和相應的剪切應力模式不僅可以調節血管內皮細胞的基因表達和細胞表型,還可以影響參與AS進展的外周細胞。簡而言之,基于相應的剪切應力機制(例如特定的機械傳感器和信號通路)的AS新治療策略正在出現。它為AS的治療提供了新的解決方案,在臨床前研究和臨床試驗中顯示出潛在的療效。此外,AS進展中機械信號通路的轉導和調控對于靶向治療的確定也非常重要。該綜述將有助于探索和應用新的治療策略,最終指出AS未來的研究方向。
參考文獻:Cheng H, Zhong W, Wang L, Zhang Q, Ma X, Wang Y, Wang S, He C, Wei Q, Fu C. Effects of shear stress on vascular endothelial functions in atherosclerosis and potential therapeutic approaches. Biomed Pharmacother. 2023 Feb;158:114198. doi: 10.1016/j.biopha.2022.114198. Epub 2023 Jan 3. PMID: 36916427.
原文鏈接:https://pubmed.ncbi.nlm.nih.gov/36916427/
Impact Factor 7.5
Online ISSN: 1950-6007
Print ISSN: 0753-3322
小編旨在分享、學習、交流生物科學等域的研究進展。如有侵權或引文不當請聯系小編修正。
微信搜索公眾號“Naturethink”,了解更多細胞體外仿生培養技術及應用。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com