脆性X染色體綜合征及診斷技術
前言:今天是第16個“國際罕見病日”,主題為“Share your colours”,中文譯為“點亮生命的色彩”。根據《中國罕見病定義研究報告2021》,罕見病的定義為新生兒發病率小于萬分之一、患病率小于萬分之一、患病絕對人數小于14萬的疾病。
盡管我國于2022年迎來人口負增長的時代,但龐大的人口數量和環境、飲食等因素的影響,我國患罕見病的總人數并不少。新生人口數量的斷崖式下降,意味著新生人口的質量將更受重視,倡導“優生優育”的政策支持力度勢必會進一步加大。為保證新生兒出生質量,出生缺陷的相關篩查尤為重要,例如唐氏綜合征,脊髓性肌萎縮癥,脆性X染色體綜合征,遺傳性耳聾,地中海貧血綜合癥,子癇等等。其中,與新生兒智力及發育障礙的篩查更是重中之重。
01脆性X染色體綜合征簡介
眾所周知,唐氏綜合征(21號染色體三體綜合征)是引起新生兒智力和發育障礙的最主要因素。隨著基于二代測序技術(NGS)的無創產前檢測篩查(NIPT)在我國的大力推廣和廣泛普及,對唐氏綜合征的防控取得了非常顯著的臨床及社會效益。而僅次于唐氏綜合征,為引起智力及發育障礙的第二大病因的脆性X染色體綜合征(Fragile X Syndrome,FXS)[1],人們卻普遍缺乏關注和認知。脆性X染色體綜合征是繼唐氏綜合癥之后導致智力殘疾的第二大原因,也是導致智力及發育障礙的第一大單基因遺傳病,更是男性智力殘疾的最普遍原因。鑒于該病的相對高發生率及其復雜的臨床管理(尚無有效的藥物和療法),罹患疾病將給患者及其家庭造成嚴重的經濟負擔和精神負擔[2]。
脆性X染色體綜合征的患者一條X染色體的長壁2區7帶(Xq27)到長壁的2區8帶(Xq28)之間的染色體結構呈細絲樣,表現在X染色體的長臂末端出現“縊溝”,這段連接較細而致其相連的末端呈隨體樣的結構,參見圖1[3]。由于這一細絲樣的部位易發生斷裂、丟失,因而被稱為脆性部位。脆性部位發生上述改變而引發的疾病被稱為脆性X染色體綜合征,屬于X連鎖顯性遺傳病。脆性X染色體綜合征迄今尚無針對性療法,更無法治愈。 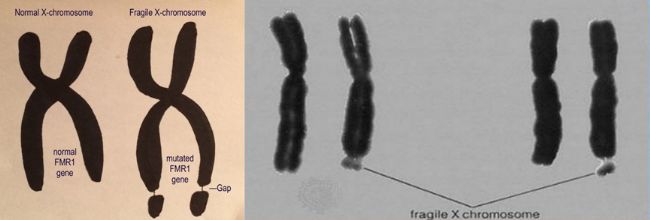
圖1. 脆性X染色體的示意圖和顯微鏡照片
臨床表型范圍廣
FXS主要涉及中樞神經系統,不僅表現為孤立的智力障礙,而且表現為多系統疾病。男性FXS患者多且癥狀較嚴重,典型的癥狀為:特殊的面容(長條面型),主要是大耳朵和耳朵外凸、大嘴、前額突出、突下頜(參見圖2);智力發育障礙,語言障礙、行為異常(多動、沖動、焦慮及癲癇發作),對外界刺激反映遲鈍等;大睪丸即巨睪癥等。女性常為攜帶者,女性攜帶者約1/3表現出智力低下或其他癥狀,但大多數較輕;女性FXS患者癥狀較輕,主要是精神問題、輕度的認知損害、易害羞和焦慮、奇怪的交流方式和怪癖等[4]。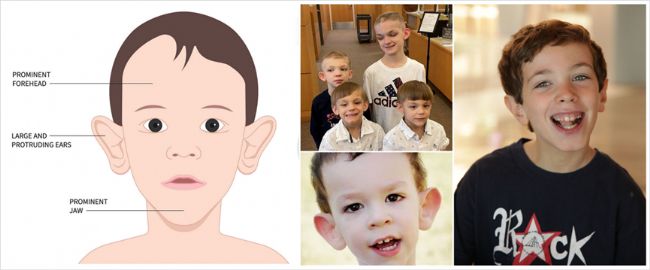
圖2. FXS患者的典型面容特征:寬額頭,長下顎,尤為突出的耳廓
FXS還與自閉癥(ASD)和多動癥(ADHD)存在密切關系。在所有被診斷患有ASD的病例中,約有2%歸因于FXS。而超過60%的FXS兒童被診斷患有ADHD,ASD或兩者兼有[5]。FXS是ASD的主要已知遺傳原因,有20%的ASD病例被認為是單基因突變的結果,只有2%至6%是由于FMR1基因突變[6]。值得額外重視的是,我國的ASD患者已突破1300萬,其中超過300萬人為14歲以下的兒童,特別是近年來我國城市兒童中ASD發生率呈現出上升趨勢。
發病率不容忽視
全球每4000名男性和每8000名女性中就分別有1人患病。致病前突變在普通人群中則更為普遍,約每250-300名女性、每850名男性中就分別有1人是攜帶者[7]。目前尚缺乏中國人群的患病率信息,也從側面說明尚引起國人的足夠重視。FXS大致占到男性智力低下患者的4%到8%。在女性人群中相應來的略低。在一般人群中隨機選擇的300名女性中就有一名可能產下受影響的男嬰。
分子病因
FXS是由于脆性X智力低下蛋白(FMRP)缺失引起。FMRP缺失的主要機制是編碼FMRP的 FMR1基因的5’UTR區CGG三核苷酸重復動態擴增異常,導致該區域異常甲基化,隨后發生轉錄沉默,即異常擴增引起轉錄過程受阻,參見圖3[8]。FXS本質上是一種三核苷酸重復擴增的動態突變疾病。FMR1基因的CGG核酸三聯體重復的數目(CGG)n會導致三種不同的疾病狀態,具體取決于重復次數和性別。
圖3. FMR1的CGG重復長度對FMR1 mRNA和FMRP蛋白合成的影響
(A) 攜帶 <45 個 CGG 重復的等位基因表達和翻譯正常;
(B) CGG重復擴增到突變前范圍(包含55-200個CGG重復序列)導致FMR1 mRNA轉錄本上調,但FMRP蛋白水平表現出一定的降低,此外,還會翻譯產生有害的polyG蛋白物(紅色形狀);
(C) CGG重復擴增到整個突變范圍(200+重復)導致FMR1基因的高甲基化,導致轉錄和翻譯的完全沉默,FMRP蛋白缺失。
(1)正常型:健康個體的CGG重復次數少于44次。
(2)中間突變型和前突變型:FMR1中間和前突變攜帶者的重復數分別在45-54和55-200之間,與正常個體相比,FMRP蛋白水平下降。中間和前突變增加了這些攜帶者發展為男性的FXTAS(脆性X相關性震顫/共濟失調綜合征)和女性的FXPOI(原發性卵巢功能不全)兩種疾病的風險和概率。在女性中,55-200個重復等位基因可能因月經初潮缺失或卵泡過早耗竭而表現為FXPOI。
(3)全突變型:在重復超過200次的情況下稱為完全突變型,FMR1基因高甲基化和完全沉默,這是FXS的主要原因。當(CGG)n重復數超過200時則為完全突變,常伴有CpG島異常甲基化,使FMR1無法正常被轉錄翻譯出正常的FMRP蛋白。
(4)導致FXS的其他變異:除FMR1啟動子區域的CGG擴增外,少數FXS病例是由編碼區突變或FMR1基因缺失引起的。FMR1基因內單核苷酸變異(SNVs)、短的插入或缺失(InDel)和微缺失,以及包含部分或整個FMR1基因座的缺失盡管少見,但也能引起FMRP的表達異常或者產生不同功能的FMRP,從而形成類似脆性X染色體綜合征的臨床癥狀[9,10,11]。目前的研究表明,有近5%的FXS是由這些變異所導致的。 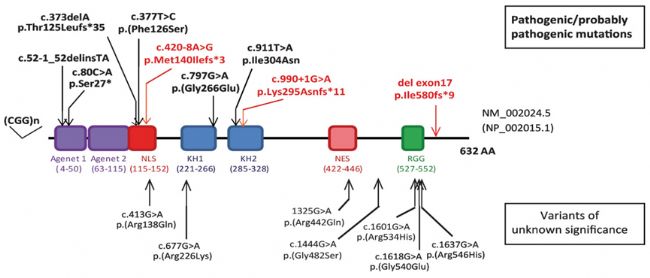
除了CGG重復次數的多少之外,插入的AGG可中斷CGG的重復,在一定情況下可降低攜帶突變前等位基因的女性將完全突變傳遞給后代的風險。在沒有AGG插入的母體等位基因,子代發生FRM1全突變擴增的風險最大,而即使存在單個AGG插入也會顯著降低這種風險,特別是對于重復次數<70的等位基因。當重復次數超過70個CGG三聯體時,即使存在AGG插入中斷,等位基因也表現出高度的不穩定性,當CGG重復數超過90時,AGG插入中斷則沒有任何能力阻止三聯體的動態擴增。
特別注意本病的前突變的傳遞方式即表型正常的男性,傳遞者的前突變基因傳遞給女兒的時候,重復突變不變或者減少。無臨床癥狀的前突變的女性攜帶者在傳遞給下一代時,重復數目明顯增加,后代可出現男性患者,通常由前突變發生動態擴增為,全突變的概率約為80%,前突變重復數目越多。女性配子減數分裂過程中,動態擴增的可能性就越大,越易產生全突變。
02FXS的診斷與篩查
臨床診斷
脆性X綜合征通過臨床表現和染色體檢查兩方面結合進行臨床診斷,可以促進FXS中基因型 - 表型相關性的研究,并為患者及其親屬提供更有效的診斷和遺傳咨詢。
疾病篩查
美國兒科學會目前的建議有智力障礙、整體發育遲緩或突變或突變前疾病家族史的人均應進行FXS的診斷與篩查,適合進行FXS篩查與診斷的人群有:
(1)育齡女性:脆性X綜合征是一種發病率僅次于唐氏綜合征的疾病;女性攜帶者生產的子代患病機率可高達25%(男孩高達50%),建議所有育齡女性都要接受脆性X綜合征產前篩查。
(2)脆性X綜合征疑似人群:有不明原因智力低下、發育遲緩、自閉癥/孤獨癥、多動癥、狂躁癥、行為障礙和語言障礙的兒童診斷檢測。
(3)胎兒(孕婦為脆性X前突變攜帶者):當母親為脆性X綜合征前突變攜帶者時,建議對胎兒行產前檢測。
(4)其他脆性X前突變攜帶者:脆性X綜合征家族史的人群,不明原因智力低下家族史的人群,有卵巢早衰、絕經過早及其家族史的人群,不孕、早產、胎停育、反復流產的女性,有震顫/共濟失調及其家族史的人群。
產前篩查
FXS分子測試通常采集外周血淋巴細胞使用臨床推薦的方法進行檢測。此外,還可以使用基于LR-PCR的方案對絨毛膜絨毛或羊膜細胞的DNA進行FXS的產前測試。目前,根據ACMG(美國醫學遺傳學學院)和ACOG(美國婦產科醫師大會)指南,有以下個人或家族史的夫婦應進行FMR1產前檢測:
(1)存在FXS或FX相關疾病史;
(2)存在不明原因的智力障礙或發育遲緩;
(3)存在孤立性認知障礙;
(4)自閉癥;
(5)單純性小腦性共濟失調伴震顫等。
此外,鑒于FXS在普通人群中的發病率較高,一定比例的遺傳健康專家支持對所有要求進行分析的女性進行產前檢測,無論其個人/家族史如何。
03分子診斷與篩查的技術方法
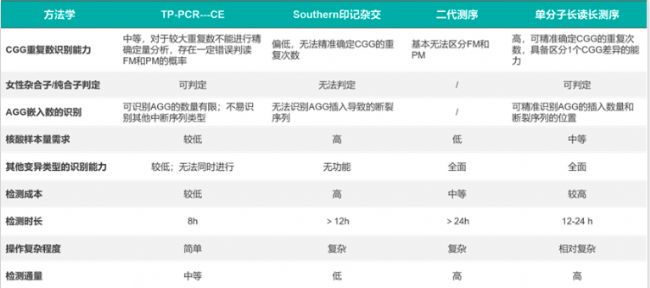
臨床上常用的FXS診斷方法有:脆性X染色體核型分析;分子診斷方法,如:三重復引物 PCR 法(triple repeat–primed PCR,TP–PCR)聯合毛細管電泳(CE)片段分析法、DNA印跡雜交法(Southern blot, SB)等。此外,還可以對CGG甲基化程度進行測試以評估FMRP是否沉默,例如甲基化敏感長距離PCR (MS-LR-PCR)試劑盒來測量每個FMR1等位基因的甲基化分數。但仍需要一種全面、精準且高效的FXS基因檢測手段。
單分子長讀長測序在一次分析中,可準確分析FRM1基因中的CGG串聯重復數量,識別AGG等插入中斷,以及導致FMRP蛋白功能缺失的其他突變(SNV、InDel及微缺失)等,真正達到精準全面。
傳動方法尚存局限
CGG重復擴增是神經元核內包涵體疾病和一系列臨床表型的原因。CGG串聯重復擴展難以被有效擴增和檢測。目前,臨床上常用于FRM1基因的CGG串聯重復的的分子診斷的TP-PCR(三重復引物PCR)和Southern 印跡雜交等方法,存在設計及操作繁瑣、有效率不高和通量低,并且不適合對多個基因區域進行并行分析的不足。
Southern 印跡雜交
被認為是檢測大片段STR擴增的金標準,但這種方法耗時長、效率低、成本高昂、檢測通量低,并且單次分析需要大量(高達10 μg)的高質量DNA。Southern 印跡雜交還無法檢測分析較大的長片段的STR,參見圖5;更加無法檢測到SNV和InDel等致病突變 [12]。
三重復引物PCR (TP-PCR)
與Southern 印跡雜交相比,靈敏度更高,周轉時間更短,通量更高,也更便宜。TP-PCR理論上可檢測所有FMR1全突變,全突變病例無論包含多少個CGG重復數,TP-PCR擴增子峰將超過FXS的200個CGG重復的致病性閾值[13,14]。TP-PCR還可以對FMR1動態突變中的AGG中斷模式進行表征, 但無法檢測到新的插入中斷類型,表征能力有效。由于特別的設計,在擴增的樣品中,TP-PCR將產生高度異質的擴增子片段,這些片段在電泳時表現出特征性的“卡頓”模式,參見圖5。但由于高度重復的區域被擴增,擴增產物片傾向于為較短的讀段,使得難以準確確定擴展重復的真實長度,參見圖5,導致有時會無法準確區分全突變(FM)和前突變(PM)類型[12]。此外,在具有高GC含量的大重復序列(GC含量高的區域導致的二級結構形成會對PCR擴增的效率產生顯著影響)、重復的側翼區域或側翼變體中,開發出有效的PCR引物及體系都極具挑戰性。目前,優化的TP-PCR方法可以檢測多達900個六核苷酸重復的擴展重復大小,但仍舊無法準確確定更大的重復重復單元數[15]。此外,TP-PCR還無法同時評估FRM1基因中的致病SNV和InDel等其他變異。
二代測序(NGS)
雖然NGS在臨床上使用越來越多,但短讀長的NGS平臺無法對大型和/或復雜的串聯重復擴增進行準確分析,基本無法對FRM1中的CGG串聯重復數進行有效檢測分辨。首先,高度重復和/或富含GC的基因組區域對NGS文庫制備、PCR擴增和測序均存在挑戰,因此難以對許多STR區域進行足夠深度的覆蓋。其次,由于STR區域的重復性可能導致與參考基因組進行比對時,將reads進行錯誤的拼接和組裝。更為根本的是,NGS技術的短讀長度(~300bp)不足以跨越大的STR區域,因此無法精確確定其長度,參見圖6。上述這些限制阻礙了NGS在STR導致的動態疾病臨床診斷中的應用[12]。但NGS可以通過對FRM1基因的全長覆蓋來檢測致病的SNV、InDel等。
單分子長讀長測序診斷優勢顯著(更準確,更全面)
單分子測序長讀長測序技術無需引入額外的PCR擴增,因此不受高GC含量的影響。此外,與短讀長NGS相比,長讀長的單條reads可跨越大片段的串聯重復擴增的整個區域,非常準確的計算出串聯重復數,參見圖6。基于單分子測序的長讀長測序可有效讀取整個串聯重復區域的長度,并克服了使用短讀長無法有效和準確識別串聯重復單元數量或使用RP-PCR(如TP-PCR)和Southern 印跡需創建重復引物探針的傳統局限和不足[12]。

可準確識別AGG等中斷位點:研究表明,AGG中斷對于攜帶60到84個CGG重復的女性影響深遠,應向具有前突變的女性提供的更準確的風險評估,可指導最合適的生殖策略,如進行三代試管嬰兒。但傳統方法的局限阻礙了AGG的分析,而單分子長讀長單分子測序可產生高質量的結果,并允許明確構建女性兩條X染色體的重復結構[16]。將AGG分析納入FMR1診斷檢查可以準確評估攜帶前突變的母親將全突變遺傳給子代的風險,這極大地改善了攜帶前突變的女性的遺傳咨詢。單分子測序提供FMR1 CGG重復序列的直接讀數,因此可以掌握完整的重復序列[17]。單分子測序進行的AGG分析產生了明確的結果,有助于確定具有突變前的女性的準確擴增風險,從而對遺傳咨詢產生積極影響。
可全面覆蓋其他致病變異:值得注意的是,FMR1基因內單核苷酸變異(SNV)、短的插入或缺失(InDel)和微缺失,以及包含部分或整個FMR1基因座的大缺失也是5%左右的FXS的致病原因,而這些變異的檢測由于需要結合多種不同的技術方法且成本高昂,長期以來沒有有效的解決方法。而長讀長測序在可有效檢測FRM1的CGG串聯重復時,也可同時全面覆蓋上述這些致病變異,達到一網打盡的目的。總之,長讀長測序能夠快速且具有成本效益的方式準確分析短串聯重復擴增,在包括FXS等串聯重復動態突變疾病的診斷上優勢顯著,大有可為[18,19]。
04FXS的治療進展
治療方法有限
目前尚無有效的治療藥物和療法。其治療主要是:早期干預,針對各種認知交流和行為損害可采用語言訓練、認知訓練、感覺統合訓練、聽覺統合訓練、結構化的學習環境和行為管理等綜合治療。因男性的癥狀比較重,智力、行為方面的問題比較明顯,強調要早發現、早治療。特殊教育、行為療法、藥物治療等有一定治療效果,有助于改善患者行為能力,提高生活質量,可一定程度降低對患兒將來的生活和學習的影響。
基因療法進展
基因療法、基因再激活和蛋白替代療法因可從源頭上治療脆性X綜合征而被寄予厚望,目前這些療法仍處于臨床研究的早期階段。
靶向治療進展
針對FMRP蛋白的下游通路進行靶向干預,同樣具有廣闊的治療前景。這些療法涉及中樞神經系統的多種機制,靶點選擇多樣,包括突觸生長因子、Sigma-1受體、大麻素受體、核糖體蛋白S6激酶1、血清素、鉀離子通道等。同樣,目前這些療法仍處于臨床研究的早期階段。
一級預防至關重要
通過基因篩查確定攜帶者或患者,確診后應對患者的一級親屬進行檢查,檢出前突變或全突變攜帶者,通過遺傳咨詢、產前診斷、三代試管嬰兒技術等避免子代患病。
05小結與展望
脆性X綜合征是是繼唐氏綜合征之后的第二大智力障礙的病因,也是導致智力障礙和自閉癥等精神障礙最多的單基因疾病,目前在我國收到人們的關注和重視的程度上不及發達國家。對育齡婦女和新生兒進行FXS分子檢測篩查,可以識別出FMR1擴增的異常,可能從診斷和測試后遺傳咨詢中獲益。阻礙對FMR1擴增異常進行大規模篩查的一個重要因素是目前尚缺乏靈敏度高、通量高且具有成本效益的檢測方法和產品。
針對串聯重復擴增導致的疾病的臨床診斷方法開發起來非常困難且耗時,且通常無法準確評估具有高GC含量的較長的STR區域。大片段的CGG串聯重復通常難以被準確擴增和檢測,超出了目前臨床上常用的分子診斷技術的能力。
單分子長讀長測序技術可對FMR1基因中CGG重復擴增、SNV、InDel及微缺失/缺失等平行分析,可以完整表征具有正常,前突變和全突變狀態。當沒有檢測到典型的CGG重復擴增時,通過鑒定FMR1基因內的致病變異來完成突變測試。真正做到單次檢測,一網打盡,而無需使用多種方法的組合才能完全覆蓋可能導致FXS的變異。其檢測效率和準確度度遠優于傳統FXS分子檢測方法。還可實現篩診一體,為FXS精準防控及遺傳咨詢提供了強有力工具,具有廣闊的臨床應用前景。
此外,診斷成本也是在臨床實踐中必須考慮的問題,目前,長讀長測序方法的成本還相對較高,無法支持臨床上的廣泛應用,有待進一步降低成本,以便更廣泛地應用在包括FXS等動態突變疾病的診療中來。
參考文獻
[1]. Epidemiology of fragile X syndrome: a systematic review and meta-analysis. Am J Med Genet A. 2014;164A(7):1648–58.
[2]. Fragile X syndrome: clinical presentation, pathology and treatment. Gac Med Mex. 2020;156:58-64.
[3]. Fragile X syndrome. Nat Rev Dis Primers . 2017 Sep 29;3:17065.
[4]. Fragile X syndrome: clinical presentation, pathology and treatment. Gac Med Mex. 2020;156:58-64.
[5]. Autism spectrum disorder genomics: The progress and potential of genomic technologies. Genomics . 2020 Nov;112(6):5136-5142.
[6]. A perspective on molecular signalling dysfunction, its clinical relevance and therapeutics in autism spectrum disorder. Exp Brain Res . 2022 Oct;240(10):2525-2567.
[7]. Fragile X syndrome: a review of clinical and molecular diagnoses. Acta Neuropathol Commun . 2021 May 25;9(1):98.
[8]. Fragile X syndrome and associated disorders: Clinical aspects and pathology. Neurobiol Dis . 2020 Mar;136:104740.
[9]. Two novel intragenic variants in the FMR1 gene in patients with suspect clinical diagnosis of Fragile X syndrome and no CGG repeat expansion. Eur J Med Genet. 2020 Oct;63(10):104010.
[10]. Intragenic FMR1 disease-causing variants: a significant mutational mechanism leading to Fragile-X syndrome. Eur J Hum Genet. 2017 Apr;25(4):423-431.
[11]. Rare FMR1 gene mutations causing fragile X syndrome: A review. Am J Med Genet A . 2018 Jan;176(1):11-18. doi: 10.1002/ajmg.a.38504. Epub 2017 Nov 27.
[12]. An update on the neurological short tandem repeat expansion disorders and the emergence of long-read sequencing diagnostics. Acta Neuropathol Commun . 2021 May 25;9(1):98.
[13]. Triplet-Primed PCR Assays for Accurate Screening of FMR1 CGG Repeat Expansion and Genotype Verification. Curr Protoc . 2022 May;2(5):e427.
[14]. Improved PCR based methods for detecting C9orf72 hexanucleotide repeat expansions. Mol Cell Probes . 2016 Aug;30(4):218-224.
[15]. A blinded international study on the reliability of genetic testing for GGGGCC-repeat expansions in C9orf72 reveals marked differences in results among 14 laboratories. J Med Genet . 2014 Jun;51(6):419-24.
[16]. Detecting AGG Interruptions in Females With a FMR1 Premutation by Long-Read Single-Molecule Sequencing: A 1 Year Clinical Experience. Front Genet . 2018 May 16;9:150.
[17]. Detecting AGG Interruptions in Male and Female FMR1 Premutation Carriers by Single-Molecule Sequencing. Hum Mutat . 2017 Mar;38(3):324-331.
[18]. Characterization of FMR1 Repeat Expansion and Intragenic Variants by Indirect Sequence Capture. Front Genet . 2021 Sep 27;12:743230.
[19]. Parallel in-depth analysis of repeat expansions in ataxia patients by long-read sequencing. Brain . 2022 Oct 13;awac377.
盡管我國于2022年迎來人口負增長的時代,但龐大的人口數量和環境、飲食等因素的影響,我國患罕見病的總人數并不少。新生人口數量的斷崖式下降,意味著新生人口的質量將更受重視,倡導“優生優育”的政策支持力度勢必會進一步加大。為保證新生兒出生質量,出生缺陷的相關篩查尤為重要,例如唐氏綜合征,脊髓性肌萎縮癥,脆性X染色體綜合征,遺傳性耳聾,地中海貧血綜合癥,子癇等等。其中,與新生兒智力及發育障礙的篩查更是重中之重。
01脆性X染色體綜合征簡介
眾所周知,唐氏綜合征(21號染色體三體綜合征)是引起新生兒智力和發育障礙的最主要因素。隨著基于二代測序技術(NGS)的無創產前檢測篩查(NIPT)在我國的大力推廣和廣泛普及,對唐氏綜合征的防控取得了非常顯著的臨床及社會效益。而僅次于唐氏綜合征,為引起智力及發育障礙的第二大病因的脆性X染色體綜合征(Fragile X Syndrome,FXS)[1],人們卻普遍缺乏關注和認知。脆性X染色體綜合征是繼唐氏綜合癥之后導致智力殘疾的第二大原因,也是導致智力及發育障礙的第一大單基因遺傳病,更是男性智力殘疾的最普遍原因。鑒于該病的相對高發生率及其復雜的臨床管理(尚無有效的藥物和療法),罹患疾病將給患者及其家庭造成嚴重的經濟負擔和精神負擔[2]。
脆性X染色體綜合征的患者一條X染色體的長壁2區7帶(Xq27)到長壁的2區8帶(Xq28)之間的染色體結構呈細絲樣,表現在X染色體的長臂末端出現“縊溝”,這段連接較細而致其相連的末端呈隨體樣的結構,參見圖1[3]。由于這一細絲樣的部位易發生斷裂、丟失,因而被稱為脆性部位。脆性部位發生上述改變而引發的疾病被稱為脆性X染色體綜合征,屬于X連鎖顯性遺傳病。脆性X染色體綜合征迄今尚無針對性療法,更無法治愈。

圖1. 脆性X染色體的示意圖和顯微鏡照片
臨床表型范圍廣
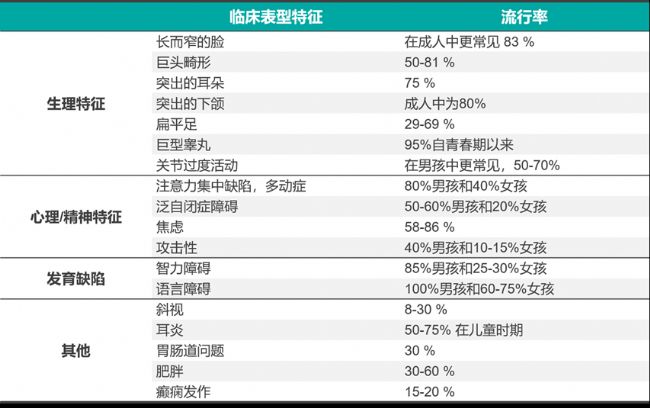
FXS主要涉及中樞神經系統,不僅表現為孤立的智力障礙,而且表現為多系統疾病。男性FXS患者多且癥狀較嚴重,典型的癥狀為:特殊的面容(長條面型),主要是大耳朵和耳朵外凸、大嘴、前額突出、突下頜(參見圖2);智力發育障礙,語言障礙、行為異常(多動、沖動、焦慮及癲癇發作),對外界刺激反映遲鈍等;大睪丸即巨睪癥等。女性常為攜帶者,女性攜帶者約1/3表現出智力低下或其他癥狀,但大多數較輕;女性FXS患者癥狀較輕,主要是精神問題、輕度的認知損害、易害羞和焦慮、奇怪的交流方式和怪癖等[4]。

圖2. FXS患者的典型面容特征:寬額頭,長下顎,尤為突出的耳廓
FXS還與自閉癥(ASD)和多動癥(ADHD)存在密切關系。在所有被診斷患有ASD的病例中,約有2%歸因于FXS。而超過60%的FXS兒童被診斷患有ADHD,ASD或兩者兼有[5]。FXS是ASD的主要已知遺傳原因,有20%的ASD病例被認為是單基因突變的結果,只有2%至6%是由于FMR1基因突變[6]。值得額外重視的是,我國的ASD患者已突破1300萬,其中超過300萬人為14歲以下的兒童,特別是近年來我國城市兒童中ASD發生率呈現出上升趨勢。
表1. FXS的臨床表型特點,不僅僅是一種智力障礙疾病,還會表現出多系統性疾病的表型

發病率不容忽視
全球每4000名男性和每8000名女性中就分別有1人患病。致病前突變在普通人群中則更為普遍,約每250-300名女性、每850名男性中就分別有1人是攜帶者[7]。目前尚缺乏中國人群的患病率信息,也從側面說明尚引起國人的足夠重視。FXS大致占到男性智力低下患者的4%到8%。在女性人群中相應來的略低。在一般人群中隨機選擇的300名女性中就有一名可能產下受影響的男嬰。
分子病因
FXS是由于脆性X智力低下蛋白(FMRP)缺失引起。FMRP缺失的主要機制是編碼FMRP的 FMR1基因的5’UTR區CGG三核苷酸重復動態擴增異常,導致該區域異常甲基化,隨后發生轉錄沉默,即異常擴增引起轉錄過程受阻,參見圖3[8]。FXS本質上是一種三核苷酸重復擴增的動態突變疾病。FMR1基因的CGG核酸三聯體重復的數目(CGG)n會導致三種不同的疾病狀態,具體取決于重復次數和性別。

圖3. FMR1的CGG重復長度對FMR1 mRNA和FMRP蛋白合成的影響
(B) CGG重復擴增到突變前范圍(包含55-200個CGG重復序列)導致FMR1 mRNA轉錄本上調,但FMRP蛋白水平表現出一定的降低,此外,還會翻譯產生有害的polyG蛋白物(紅色形狀);
(C) CGG重復擴增到整個突變范圍(200+重復)導致FMR1基因的高甲基化,導致轉錄和翻譯的完全沉默,FMRP蛋白缺失。
(1)正常型:健康個體的CGG重復次數少于44次。
(2)中間突變型和前突變型:FMR1中間和前突變攜帶者的重復數分別在45-54和55-200之間,與正常個體相比,FMRP蛋白水平下降。中間和前突變增加了這些攜帶者發展為男性的FXTAS(脆性X相關性震顫/共濟失調綜合征)和女性的FXPOI(原發性卵巢功能不全)兩種疾病的風險和概率。在女性中,55-200個重復等位基因可能因月經初潮缺失或卵泡過早耗竭而表現為FXPOI。
(3)全突變型:在重復超過200次的情況下稱為完全突變型,FMR1基因高甲基化和完全沉默,這是FXS的主要原因。當(CGG)n重復數超過200時則為完全突變,常伴有CpG島異常甲基化,使FMR1無法正常被轉錄翻譯出正常的FMRP蛋白。
表2. FMR1基因啟動子區域的CGG串聯重復數量與臨床表型的關聯性


(4)導致FXS的其他變異:除FMR1啟動子區域的CGG擴增外,少數FXS病例是由編碼區突變或FMR1基因缺失引起的。FMR1基因內單核苷酸變異(SNVs)、短的插入或缺失(InDel)和微缺失,以及包含部分或整個FMR1基因座的缺失盡管少見,但也能引起FMRP的表達異常或者產生不同功能的FMRP,從而形成類似脆性X染色體綜合征的臨床癥狀[9,10,11]。目前的研究表明,有近5%的FXS是由這些變異所導致的。

圖4. 可導致FXS的部分其他明確致病變異
(圖上半部分)
除了CGG重復次數的多少之外,插入的AGG可中斷CGG的重復,在一定情況下可降低攜帶突變前等位基因的女性將完全突變傳遞給后代的風險。在沒有AGG插入的母體等位基因,子代發生FRM1全突變擴增的風險最大,而即使存在單個AGG插入也會顯著降低這種風險,特別是對于重復次數<70的等位基因。當重復次數超過70個CGG三聯體時,即使存在AGG插入中斷,等位基因也表現出高度的不穩定性,當CGG重復數超過90時,AGG插入中斷則沒有任何能力阻止三聯體的動態擴增。
特別注意本病的前突變的傳遞方式即表型正常的男性,傳遞者的前突變基因傳遞給女兒的時候,重復突變不變或者減少。無臨床癥狀的前突變的女性攜帶者在傳遞給下一代時,重復數目明顯增加,后代可出現男性患者,通常由前突變發生動態擴增為,全突變的概率約為80%,前突變重復數目越多。女性配子減數分裂過程中,動態擴增的可能性就越大,越易產生全突變。
02FXS的診斷與篩查
臨床診斷
脆性X綜合征通過臨床表現和染色體檢查兩方面結合進行臨床診斷,可以促進FXS中基因型 - 表型相關性的研究,并為患者及其親屬提供更有效的診斷和遺傳咨詢。
疾病篩查
美國兒科學會目前的建議有智力障礙、整體發育遲緩或突變或突變前疾病家族史的人均應進行FXS的診斷與篩查,適合進行FXS篩查與診斷的人群有:
(1)育齡女性:脆性X綜合征是一種發病率僅次于唐氏綜合征的疾病;女性攜帶者生產的子代患病機率可高達25%(男孩高達50%),建議所有育齡女性都要接受脆性X綜合征產前篩查。
(2)脆性X綜合征疑似人群:有不明原因智力低下、發育遲緩、自閉癥/孤獨癥、多動癥、狂躁癥、行為障礙和語言障礙的兒童診斷檢測。
(3)胎兒(孕婦為脆性X前突變攜帶者):當母親為脆性X綜合征前突變攜帶者時,建議對胎兒行產前檢測。
(4)其他脆性X前突變攜帶者:脆性X綜合征家族史的人群,不明原因智力低下家族史的人群,有卵巢早衰、絕經過早及其家族史的人群,不孕、早產、胎停育、反復流產的女性,有震顫/共濟失調及其家族史的人群。
產前篩查
FXS分子測試通常采集外周血淋巴細胞使用臨床推薦的方法進行檢測。此外,還可以使用基于LR-PCR的方案對絨毛膜絨毛或羊膜細胞的DNA進行FXS的產前測試。目前,根據ACMG(美國醫學遺傳學學院)和ACOG(美國婦產科醫師大會)指南,有以下個人或家族史的夫婦應進行FMR1產前檢測:
(1)存在FXS或FX相關疾病史;
(2)存在不明原因的智力障礙或發育遲緩;
(3)存在孤立性認知障礙;
(4)自閉癥;
(5)單純性小腦性共濟失調伴震顫等。
此外,鑒于FXS在普通人群中的發病率較高,一定比例的遺傳健康專家支持對所有要求進行分析的女性進行產前檢測,無論其個人/家族史如何。
03分子診斷與篩查的技術方法
臨床上常用的FXS診斷方法有:脆性X染色體核型分析;分子診斷方法,如:三重復引物 PCR 法(triple repeat–primed PCR,TP–PCR)聯合毛細管電泳(CE)片段分析法、DNA印跡雜交法(Southern blot, SB)等。此外,還可以對CGG甲基化程度進行測試以評估FMRP是否沉默,例如甲基化敏感長距離PCR (MS-LR-PCR)試劑盒來測量每個FMR1等位基因的甲基化分數。但仍需要一種全面、精準且高效的FXS基因檢測手段。
單分子長讀長測序在一次分析中,可準確分析FRM1基因中的CGG串聯重復數量,識別AGG等插入中斷,以及導致FMRP蛋白功能缺失的其他突變(SNV、InDel及微缺失)等,真正達到精準全面。
傳動方法尚存局限
CGG重復擴增是神經元核內包涵體疾病和一系列臨床表型的原因。CGG串聯重復擴展難以被有效擴增和檢測。目前,臨床上常用于FRM1基因的CGG串聯重復的的分子診斷的TP-PCR(三重復引物PCR)和Southern 印跡雜交等方法,存在設計及操作繁瑣、有效率不高和通量低,并且不適合對多個基因區域進行并行分析的不足。
Southern 印跡雜交
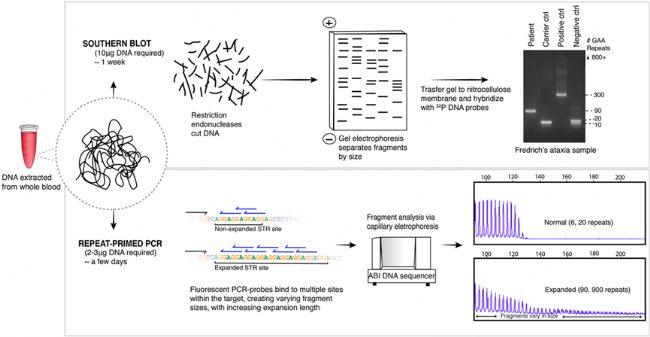
被認為是檢測大片段STR擴增的金標準,但這種方法耗時長、效率低、成本高昂、檢測通量低,并且單次分析需要大量(高達10 μg)的高質量DNA。Southern 印跡雜交還無法檢測分析較大的長片段的STR,參見圖5;更加無法檢測到SNV和InDel等致病突變 [12]。
三重復引物PCR (TP-PCR)
與Southern 印跡雜交相比,靈敏度更高,周轉時間更短,通量更高,也更便宜。TP-PCR理論上可檢測所有FMR1全突變,全突變病例無論包含多少個CGG重復數,TP-PCR擴增子峰將超過FXS的200個CGG重復的致病性閾值[13,14]。TP-PCR還可以對FMR1動態突變中的AGG中斷模式進行表征, 但無法檢測到新的插入中斷類型,表征能力有效。由于特別的設計,在擴增的樣品中,TP-PCR將產生高度異質的擴增子片段,這些片段在電泳時表現出特征性的“卡頓”模式,參見圖5。但由于高度重復的區域被擴增,擴增產物片傾向于為較短的讀段,使得難以準確確定擴展重復的真實長度,參見圖5,導致有時會無法準確區分全突變(FM)和前突變(PM)類型[12]。此外,在具有高GC含量的大重復序列(GC含量高的區域導致的二級結構形成會對PCR擴增的效率產生顯著影響)、重復的側翼區域或側翼變體中,開發出有效的PCR引物及體系都極具挑戰性。目前,優化的TP-PCR方法可以檢測多達900個六核苷酸重復的擴展重復大小,但仍舊無法準確確定更大的重復重復單元數[15]。此外,TP-PCR還無法同時評估FRM1基因中的致病SNV和InDel等其他變異。

圖5. 進行Southern 印跡雜交時,無法檢測分析較大的長片段的STR,如900 個以上的串聯重復單元。RP-PCR由重復引物探針與STR擴增內更多位點結合引起的擴增等位基因的特征拖尾/斷續模式。由于RP-PCR和Southern印跡雜交這兩種方法都需要對每個STR進行單獨的引物/探針設計,因此無法在一次測定中對多個候選靶標進行并行分析檢測。臨床醫生必須決定優先對哪些 STR 靶標進行檢測,由于臨床表型的異質性和各種重復擴張障礙之間的臨床表型重疊,給臨床醫生的抉擇帶來了非常大的挑戰和困難
二代測序(NGS)
雖然NGS在臨床上使用越來越多,但短讀長的NGS平臺無法對大型和/或復雜的串聯重復擴增進行準確分析,基本無法對FRM1中的CGG串聯重復數進行有效檢測分辨。首先,高度重復和/或富含GC的基因組區域對NGS文庫制備、PCR擴增和測序均存在挑戰,因此難以對許多STR區域進行足夠深度的覆蓋。其次,由于STR區域的重復性可能導致與參考基因組進行比對時,將reads進行錯誤的拼接和組裝。更為根本的是,NGS技術的短讀長度(~300bp)不足以跨越大的STR區域,因此無法精確確定其長度,參見圖6。上述這些限制阻礙了NGS在STR導致的動態疾病臨床診斷中的應用[12]。但NGS可以通過對FRM1基因的全長覆蓋來檢測致病的SNV、InDel等。
單分子長讀長測序診斷優勢顯著(更準確,更全面)
單分子測序長讀長測序技術無需引入額外的PCR擴增,因此不受高GC含量的影響。此外,與短讀長NGS相比,長讀長的單條reads可跨越大片段的串聯重復擴增的整個區域,非常準確的計算出串聯重復數,參見圖6。基于單分子測序的長讀長測序可有效讀取整個串聯重復區域的長度,并克服了使用短讀長無法有效和準確識別串聯重復單元數量或使用RP-PCR(如TP-PCR)和Southern 印跡需創建重復引物探針的傳統局限和不足[12]。

圖6. 使用短讀長NGS和兩種長讀長測序方法進行STR擴增檢測:NGS技術的短讀長度(~300bp)不足以跨越大的STR區域,因此無法精確確定其長度。長讀段很容易跨越重復和側翼區域,可精準的確定串聯重復單元的次數。納米孔測序的高錯誤率可以通過足夠的覆蓋深度來克服
可準確識別AGG等中斷位點:研究表明,AGG中斷對于攜帶60到84個CGG重復的女性影響深遠,應向具有前突變的女性提供的更準確的風險評估,可指導最合適的生殖策略,如進行三代試管嬰兒。但傳統方法的局限阻礙了AGG的分析,而單分子長讀長單分子測序可產生高質量的結果,并允許明確構建女性兩條X染色體的重復結構[16]。將AGG分析納入FMR1診斷檢查可以準確評估攜帶前突變的母親將全突變遺傳給子代的風險,這極大地改善了攜帶前突變的女性的遺傳咨詢。單分子測序提供FMR1 CGG重復序列的直接讀數,因此可以掌握完整的重復序列[17]。單分子測序進行的AGG分析產生了明確的結果,有助于確定具有突變前的女性的準確擴增風險,從而對遺傳咨詢產生積極影響。
可全面覆蓋其他致病變異:值得注意的是,FMR1基因內單核苷酸變異(SNV)、短的插入或缺失(InDel)和微缺失,以及包含部分或整個FMR1基因座的大缺失也是5%左右的FXS的致病原因,而這些變異的檢測由于需要結合多種不同的技術方法且成本高昂,長期以來沒有有效的解決方法。而長讀長測序在可有效檢測FRM1的CGG串聯重復時,也可同時全面覆蓋上述這些致病變異,達到一網打盡的目的。總之,長讀長測序能夠快速且具有成本效益的方式準確分析短串聯重復擴增,在包括FXS等串聯重復動態突變疾病的診斷上優勢顯著,大有可為[18,19]。
表3. 脆性X染色體綜合征FRM1基因檢測方法比較

04FXS的治療進展
治療方法有限
目前尚無有效的治療藥物和療法。其治療主要是:早期干預,針對各種認知交流和行為損害可采用語言訓練、認知訓練、感覺統合訓練、聽覺統合訓練、結構化的學習環境和行為管理等綜合治療。因男性的癥狀比較重,智力、行為方面的問題比較明顯,強調要早發現、早治療。特殊教育、行為療法、藥物治療等有一定治療效果,有助于改善患者行為能力,提高生活質量,可一定程度降低對患兒將來的生活和學習的影響。
基因療法進展
基因療法、基因再激活和蛋白替代療法因可從源頭上治療脆性X綜合征而被寄予厚望,目前這些療法仍處于臨床研究的早期階段。
靶向治療進展
針對FMRP蛋白的下游通路進行靶向干預,同樣具有廣闊的治療前景。這些療法涉及中樞神經系統的多種機制,靶點選擇多樣,包括突觸生長因子、Sigma-1受體、大麻素受體、核糖體蛋白S6激酶1、血清素、鉀離子通道等。同樣,目前這些療法仍處于臨床研究的早期階段。
一級預防至關重要
通過基因篩查確定攜帶者或患者,確診后應對患者的一級親屬進行檢查,檢出前突變或全突變攜帶者,通過遺傳咨詢、產前診斷、三代試管嬰兒技術等避免子代患病。
05小結與展望
脆性X綜合征是是繼唐氏綜合征之后的第二大智力障礙的病因,也是導致智力障礙和自閉癥等精神障礙最多的單基因疾病,目前在我國收到人們的關注和重視的程度上不及發達國家。對育齡婦女和新生兒進行FXS分子檢測篩查,可以識別出FMR1擴增的異常,可能從診斷和測試后遺傳咨詢中獲益。阻礙對FMR1擴增異常進行大規模篩查的一個重要因素是目前尚缺乏靈敏度高、通量高且具有成本效益的檢測方法和產品。
針對串聯重復擴增導致的疾病的臨床診斷方法開發起來非常困難且耗時,且通常無法準確評估具有高GC含量的較長的STR區域。大片段的CGG串聯重復通常難以被準確擴增和檢測,超出了目前臨床上常用的分子診斷技術的能力。
單分子長讀長測序技術可對FMR1基因中CGG重復擴增、SNV、InDel及微缺失/缺失等平行分析,可以完整表征具有正常,前突變和全突變狀態。當沒有檢測到典型的CGG重復擴增時,通過鑒定FMR1基因內的致病變異來完成突變測試。真正做到單次檢測,一網打盡,而無需使用多種方法的組合才能完全覆蓋可能導致FXS的變異。其檢測效率和準確度度遠優于傳統FXS分子檢測方法。還可實現篩診一體,為FXS精準防控及遺傳咨詢提供了強有力工具,具有廣闊的臨床應用前景。
此外,診斷成本也是在臨床實踐中必須考慮的問題,目前,長讀長測序方法的成本還相對較高,無法支持臨床上的廣泛應用,有待進一步降低成本,以便更廣泛地應用在包括FXS等動態突變疾病的診療中來。
參考文獻
[1]. Epidemiology of fragile X syndrome: a systematic review and meta-analysis. Am J Med Genet A. 2014;164A(7):1648–58.
[2]. Fragile X syndrome: clinical presentation, pathology and treatment. Gac Med Mex. 2020;156:58-64.
[3]. Fragile X syndrome. Nat Rev Dis Primers . 2017 Sep 29;3:17065.
[4]. Fragile X syndrome: clinical presentation, pathology and treatment. Gac Med Mex. 2020;156:58-64.
[5]. Autism spectrum disorder genomics: The progress and potential of genomic technologies. Genomics . 2020 Nov;112(6):5136-5142.
[6]. A perspective on molecular signalling dysfunction, its clinical relevance and therapeutics in autism spectrum disorder. Exp Brain Res . 2022 Oct;240(10):2525-2567.
[7]. Fragile X syndrome: a review of clinical and molecular diagnoses. Acta Neuropathol Commun . 2021 May 25;9(1):98.
[8]. Fragile X syndrome and associated disorders: Clinical aspects and pathology. Neurobiol Dis . 2020 Mar;136:104740.
[9]. Two novel intragenic variants in the FMR1 gene in patients with suspect clinical diagnosis of Fragile X syndrome and no CGG repeat expansion. Eur J Med Genet. 2020 Oct;63(10):104010.
[10]. Intragenic FMR1 disease-causing variants: a significant mutational mechanism leading to Fragile-X syndrome. Eur J Hum Genet. 2017 Apr;25(4):423-431.
[11]. Rare FMR1 gene mutations causing fragile X syndrome: A review. Am J Med Genet A . 2018 Jan;176(1):11-18. doi: 10.1002/ajmg.a.38504. Epub 2017 Nov 27.
[12]. An update on the neurological short tandem repeat expansion disorders and the emergence of long-read sequencing diagnostics. Acta Neuropathol Commun . 2021 May 25;9(1):98.
[13]. Triplet-Primed PCR Assays for Accurate Screening of FMR1 CGG Repeat Expansion and Genotype Verification. Curr Protoc . 2022 May;2(5):e427.
[14]. Improved PCR based methods for detecting C9orf72 hexanucleotide repeat expansions. Mol Cell Probes . 2016 Aug;30(4):218-224.
[15]. A blinded international study on the reliability of genetic testing for GGGGCC-repeat expansions in C9orf72 reveals marked differences in results among 14 laboratories. J Med Genet . 2014 Jun;51(6):419-24.
[16]. Detecting AGG Interruptions in Females With a FMR1 Premutation by Long-Read Single-Molecule Sequencing: A 1 Year Clinical Experience. Front Genet . 2018 May 16;9:150.
[17]. Detecting AGG Interruptions in Male and Female FMR1 Premutation Carriers by Single-Molecule Sequencing. Hum Mutat . 2017 Mar;38(3):324-331.
[18]. Characterization of FMR1 Repeat Expansion and Intragenic Variants by Indirect Sequence Capture. Front Genet . 2021 Sep 27;12:743230.
[19]. Parallel in-depth analysis of repeat expansions in ataxia patients by long-read sequencing. Brain . 2022 Oct 13;awac377.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com