分子伴侶介導的自噬對神經細胞穩態的重要調節作用
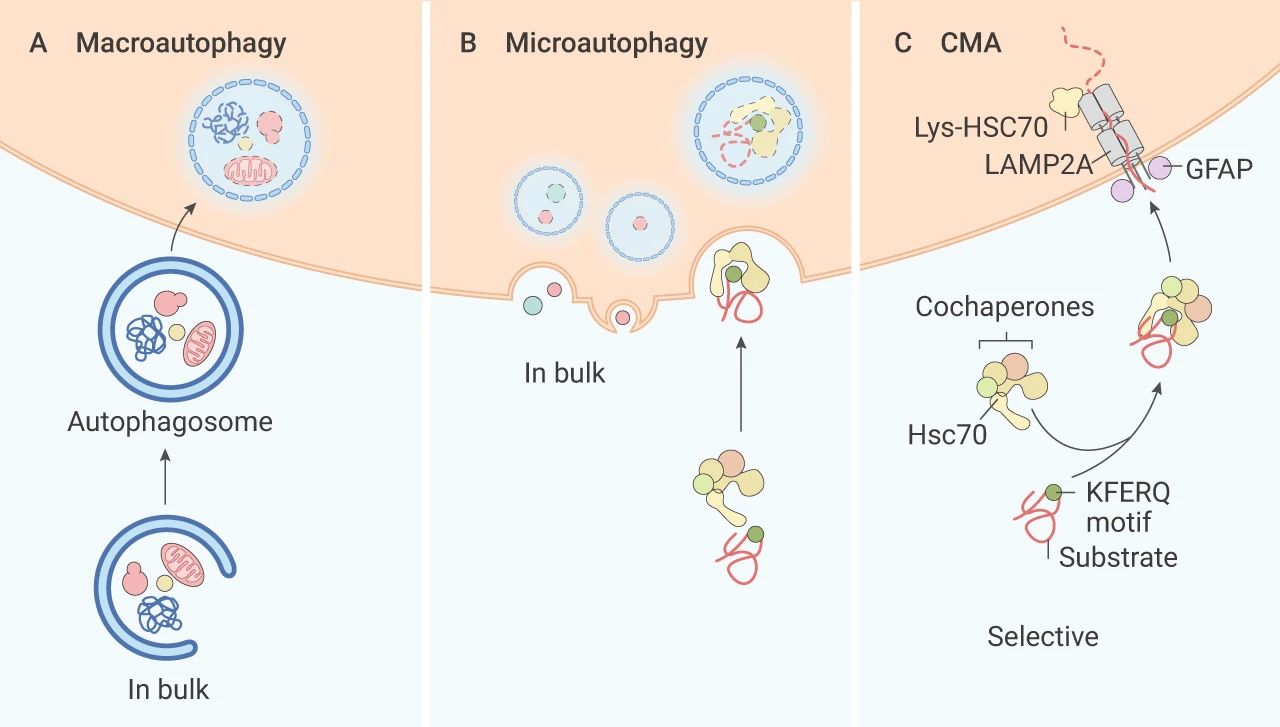
自噬是細胞在外界環境因素的影響下,利用溶酶體,降解自身受損、變性大分子物質或者細胞器的自我消化過程。依據其發生途徑,主要分為三種:巨自噬 (Macroautophagy),微自噬 (Microautophagy) 和分子伴侶介導的自噬 (Chaperone-mediated autophagy, CMA)。
巨自噬過程中,自噬體的雙膜囊泡將受損的蛋白質/細胞器傳遞至溶酶體進行降解,通常文獻中提到的自噬指的是巨自噬。微自噬也通過囊泡將物質輸送到溶酶體,溶酶體膜內陷,降解方式直接了當。
分子伴侶介導的自噬:與前兩種自噬不同,伴侶介導的自噬不使用囊泡,這種自噬方式具有高度選擇性,常借助伴侶蛋白 Hsc70,特異性降解帶有獨特識別五肽基序 (KFERQ 樣) 的靶蛋白,溶酶體膜上的受體蛋白 LAMP2A 識別結合蛋白暴露的 KFERQ 基團,“引導”目的蛋白進入溶酶體降解。
神經退行性疾病中,神經細胞往往會累積大量無法降解的蛋白,通過溶酶體自噬過程降解蛋白是細胞清除異常蛋白的主要方式。已有報道,CMA 涉及神經退行性疾病病原蛋白質 (如 α-syn 和 tau) 的降解,然而關于神經退行性疾病中 CMA 的失去功能導致的后果尚未清楚。
近日,Ana Maria Cuervo 等人在 Cell 上發表了題為 Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome 的文章,揭示了 CMA 對神經細胞穩態的重要調節作用。

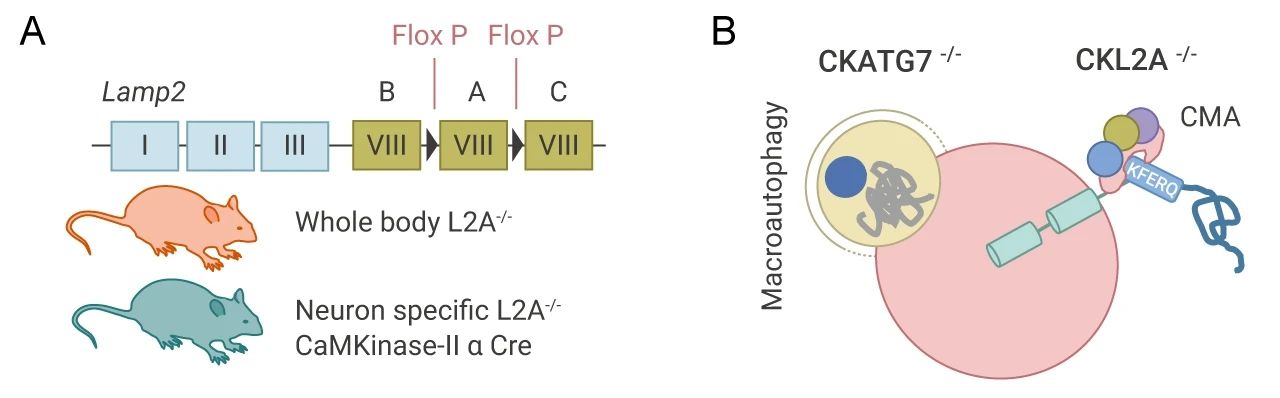
在這篇文章中,研究者們分別構建了全身性 LAMP2A (L2A) 敲除模型 (L2A-/-) 和神經元條件敲除 L2A/LAMP2a (CKL2A-/-) 小鼠模型 (圖 3A),來分析 CMA 對維持神經元蛋白質穩態的作用。還建立了模擬巨自噬缺失 (ATG7 的條件性敲除) CKATG7-/- 小鼠模型 (圖 3B),并與 CKL2A-/- 小鼠模型對比,來分析 CMA 和巨自噬這兩條自噬通路對神經元蛋白變性的特定作用。(CTR 組小鼠為不做敲除的對照組)。
■ CKL2A-/- 小鼠和 L2A-/- 小鼠所表現出的神經損害行為
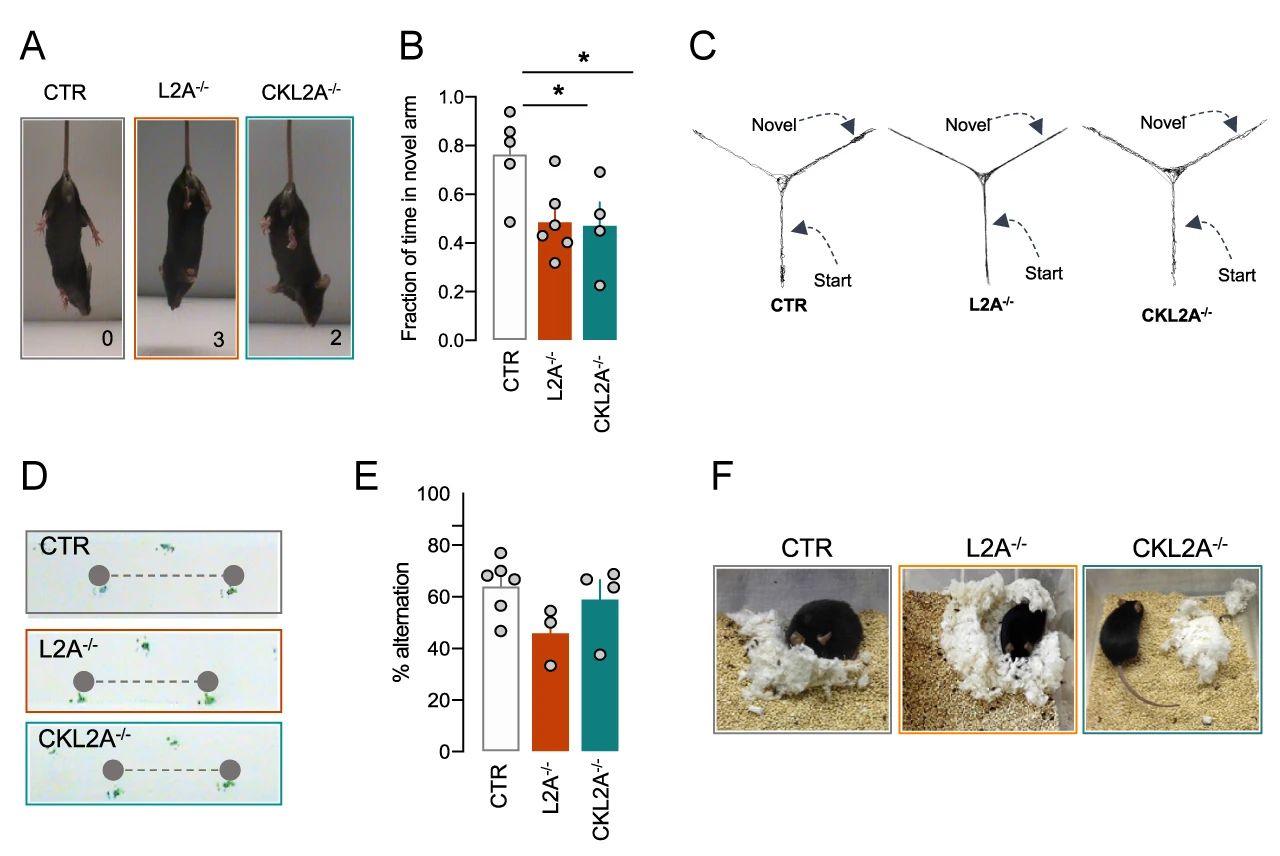
首先,研究者們發現,CKL2A-/- 小鼠和 L2A-/- 小鼠與對照組 (CTR) 相比,行為學測試得分更高,后肢緊握進展更快 (圖 4A),這兩種小鼠還均表現出了感覺運動功能障礙和 Y 型迷宮中短時記憶減少 (圖 4B-C) 。只有 L2A-/- 小鼠表現出類似帕金森疾病的步態特征,如步幅減少 (圖 4D)。此外,CKL2A-/- 小鼠還表現出了神經變性的常見表型,如有空間工作記憶減少和筑巢行為顯著減少的趨勢 (圖 4E-F)。
以上結果顯示,神經元 L2A 缺失的小鼠表現出 L2A 系統性缺失小鼠的大部分行為輸出。
■ 神經元 CMA 缺陷導致蛋白質穩態的破壞
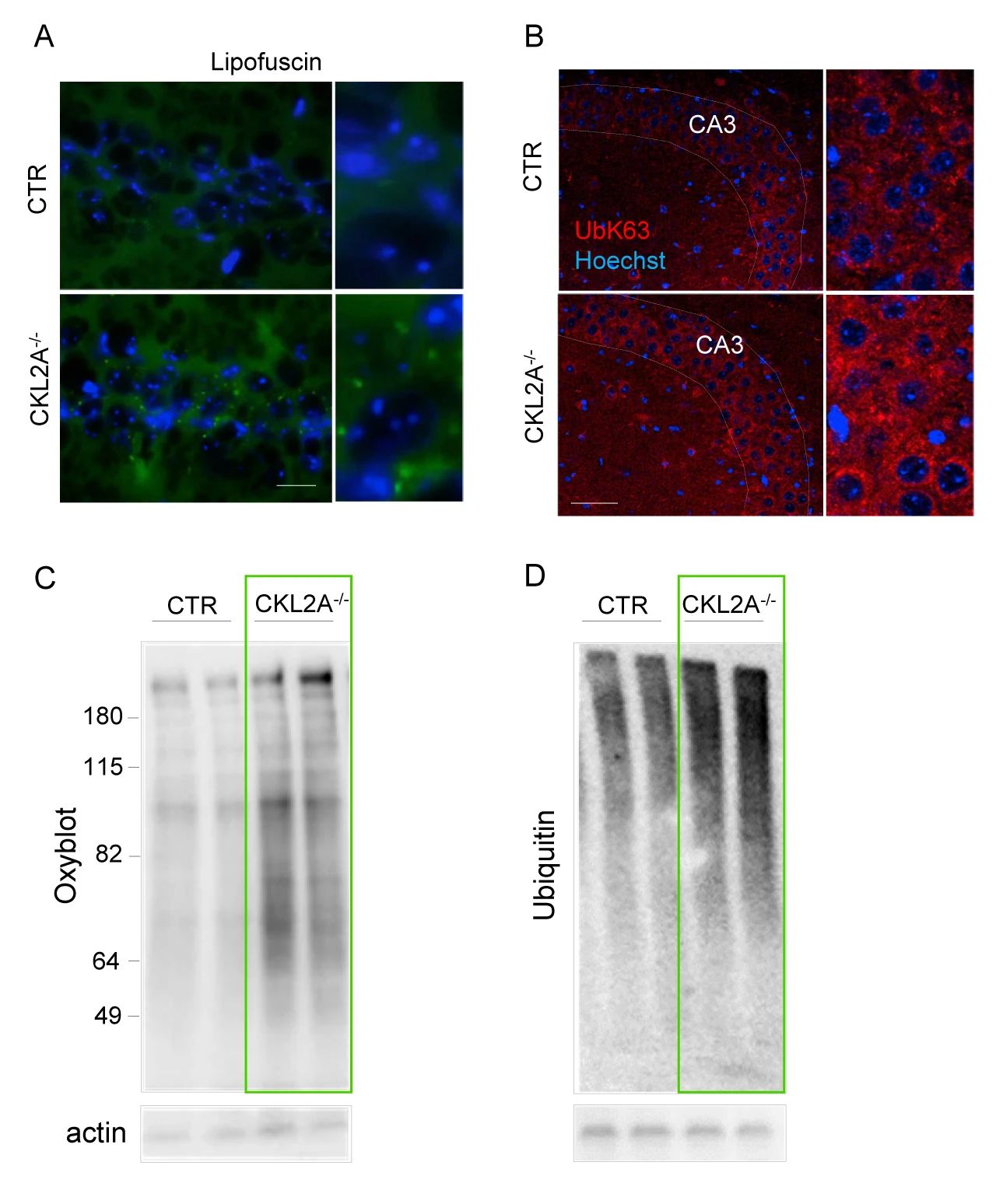
作者團隊發現,在 6 個月大的 L2A-/- 小鼠的海馬體中,出現了脂褐質和 K63 泛素化蛋白的積累 (兩個蛋白是溶酶體降解的靶蛋白),CKL2A-/- 小鼠的海馬體的錐體神經元中也發現了類似特征 (圖 5A-B)。同時 CKL2A-/- 小鼠皮質的免疫印跡分析顯示,氧化蛋白泛素化蛋白累積 (圖 5C-D),這些結果表明 CMA 缺失會導致神經元蛋白穩態的破壞。
以上結果表明,在 CMA 缺陷時轉變為不溶性的蛋白質組是過飽和蛋白質組中的一部分,并且神經元 CMA 缺失會導致蛋白質組的破壞。
■ CMA 和巨自噬對神經元蛋白質變性的影響不同
下一步,研究者們在 CKATG7-/- 小鼠和 CKL2A-/- 小鼠模型中,通過比較蛋白質組學來闡明 CMA 和巨自噬對神經元蛋白質變性的特定作用。
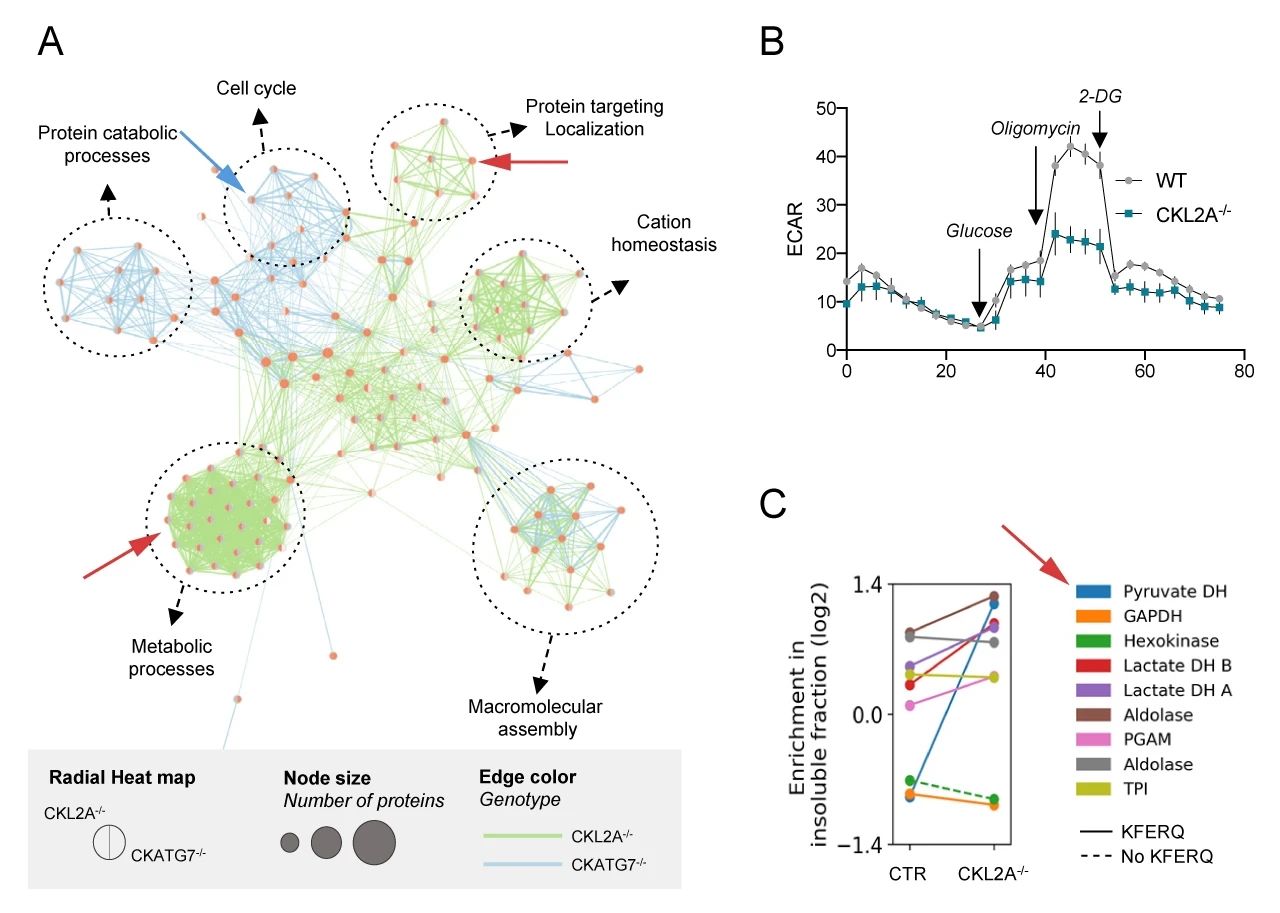
不溶性蛋白質組的基因集富集和富集圖分析 (圖 7A) 結果表明,CKATG7-/- 小鼠和 CKL2A-/- 小鼠中發生變化的蛋白質組不相同。CKATG7-/- 導致細胞周期和泛素化蛋白酶體分解代謝過程相關的蛋白變化 (藍色箭頭指出),而與 CMA 缺陷與蛋白質運輸和代謝有關 (紅色箭頭指出)。
細胞外酸化率 (ECAR) 的測定結果表明,CKL2A-/- 神經元中糖酵解的顯著減少 (圖 7B),而且很多糖酵解酶也在 CKL2A-/- 小鼠的不溶性蛋白部分中增加,如丙酮酸脫氫酶 (PDH) (圖 7C)。
雖然已有報道阻斷巨自噬也會影響神經元糖酵解,但實驗結果顯示,L2A 和 ATG7 敲低對糖酵解特性的影響并不同。以上結果表明,CMA 缺陷神經元蛋白質組向不溶性蛋白轉變后導致的結果區別于巨自噬。
基于上面的研究,推斷:神經元 CMA 被直接阻斷后,不溶性蛋白的積累和神經元功能的改變,這可能增加神經退行性疾病的易損性并加速疾病進展。
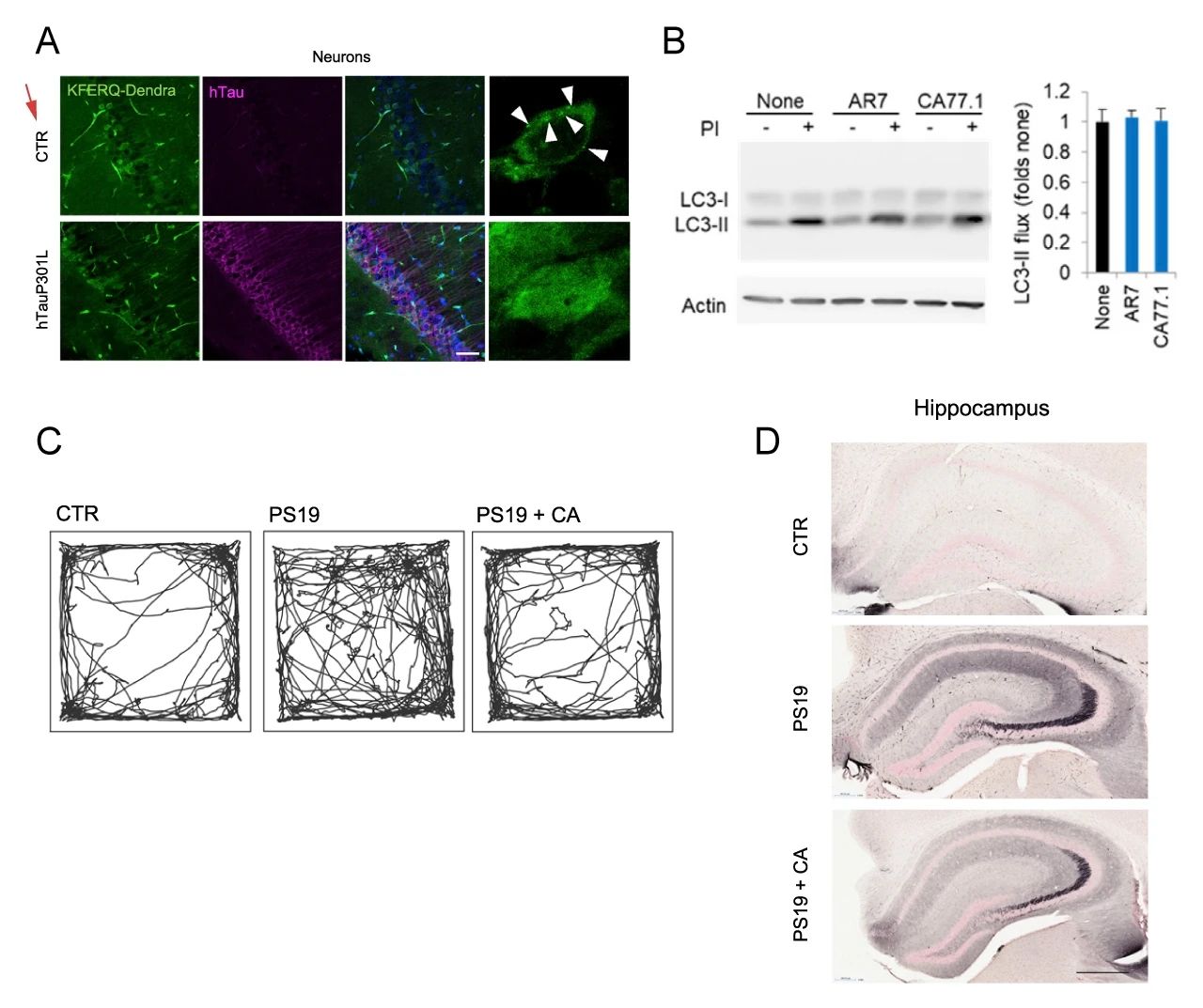
研究者建立了 hTauP301L 過表達小鼠,結果表明:其神經細胞的 CMA 活性降低,CMA 斑點數目明顯減少 (圖 8A)。研究者還建立了 P301S tau 轉基因小鼠,在該模型中使用了 CA77.1 (AR7 的衍生物) 在體外激活 CMA 且不影響巨自噬 (圖 8B)。在體內,CA77.1 給藥使得原本“凌亂”的 PS19 小鼠的正常化 (圖 8C),并顯著減少了海馬、杏仁核和梨狀皮層中含有致病性 tau 構象的神經元的數量 (圖 8D)。
總結:
這篇文章充分證明了分子伴侶自噬 (CMA) 對神經細胞穩態具有重要調節作用。
研究者們通過具有全身性和神經元特異性 CMA 阻斷的小鼠模型,證明了神經元 CMA 的缺失導致蛋白質毒性和神經元功能障礙。CMA 缺失還會使原本易于聚集的 KFERQ 樣基序蛋白質向不溶性蛋白轉變。
通過神經元特異性 CMA 和 ATG7 缺失小鼠模型,證明了 CMA 和巨自噬在調控神經元蛋白質穩態中與神經變性的亞蛋白質組并不相同。
MCE 的所有產品僅用作科學研究或藥證申報,我們不為任何個人用途提供產品和服務
參考文獻
1. Evripidis Gavathiotis, Ana Maria Cuerv, et al. Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome. Cell2021 May 13;184(10):2696-2714.e25.
2. Susmita Kaushik, Ana Maria Cuervo, et al. The coming of age of chaperone-mediated autophagy. Nat Rev Mol Cell Biol. 2018 Jun;19(6):365-381.
3. Esteban-Martı´nez, L., Sierra-Filardi, E., McGreal,R.S., Salazar-Roa, M, et al. Programmed mitophagy is essential for theglycolytic switch during cell differentiation.EMBO J. 36, 1688-1706.
巨自噬過程中,自噬體的雙膜囊泡將受損的蛋白質/細胞器傳遞至溶酶體進行降解,通常文獻中提到的自噬指的是巨自噬。微自噬也通過囊泡將物質輸送到溶酶體,溶酶體膜內陷,降解方式直接了當。
分子伴侶介導的自噬:與前兩種自噬不同,伴侶介導的自噬不使用囊泡,這種自噬方式具有高度選擇性,常借助伴侶蛋白 Hsc70,特異性降解帶有獨特識別五肽基序 (KFERQ 樣) 的靶蛋白,溶酶體膜上的受體蛋白 LAMP2A 識別結合蛋白暴露的 KFERQ 基團,“引導”目的蛋白進入溶酶體降解。

圖 1. 三種不同的自噬途徑[2]
A. 巨自噬;B. 微自噬;C. 伴侶介導的自噬
A. 巨自噬;B. 微自噬;C. 伴侶介導的自噬
神經退行性疾病中,神經細胞往往會累積大量無法降解的蛋白,通過溶酶體自噬過程降解蛋白是細胞清除異常蛋白的主要方式。已有報道,CMA 涉及神經退行性疾病病原蛋白質 (如 α-syn 和 tau) 的降解,然而關于神經退行性疾病中 CMA 的失去功能導致的后果尚未清楚。
近日,Ana Maria Cuervo 等人在 Cell 上發表了題為 Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome 的文章,揭示了 CMA 對神經細胞穩態的重要調節作用。

圖 2. Ana Maria Cuervo 等人發表的 CMA 相關文章
在這篇文章中,研究者們分別構建了全身性 LAMP2A (L2A) 敲除模型 (L2A-/-) 和神經元條件敲除 L2A/LAMP2a (CKL2A-/-) 小鼠模型 (圖 3A),來分析 CMA 對維持神經元蛋白質穩態的作用。還建立了模擬巨自噬缺失 (ATG7 的條件性敲除) CKATG7-/- 小鼠模型 (圖 3B),并與 CKL2A-/- 小鼠模型對比,來分析 CMA 和巨自噬這兩條自噬通路對神經元蛋白變性的特定作用。(CTR 組小鼠為不做敲除的對照組)。

圖 3. 建立小鼠實驗模型
A. L2A 的全身性敲除和條件敲除;B. ATG7 的條件性敲除
A. L2A 的全身性敲除和條件敲除;B. ATG7 的條件性敲除
■ CKL2A-/- 小鼠和 L2A-/- 小鼠所表現出的神經損害行為
首先,研究者們發現,CKL2A-/- 小鼠和 L2A-/- 小鼠與對照組 (CTR) 相比,行為學測試得分更高,后肢緊握進展更快 (圖 4A),這兩種小鼠還均表現出了感覺運動功能障礙和 Y 型迷宮中短時記憶減少 (圖 4B-C) 。只有 L2A-/- 小鼠表現出類似帕金森疾病的步態特征,如步幅減少 (圖 4D)。此外,CKL2A-/- 小鼠還表現出了神經變性的常見表型,如有空間工作記憶減少和筑巢行為顯著減少的趨勢 (圖 4E-F)。
以上結果顯示,神經元 L2A 缺失的小鼠表現出 L2A 系統性缺失小鼠的大部分行為輸出。

圖 4. L2A 缺失小鼠表現出行為障礙A. 鼠爪抓力測定;B-C、E. Y 型迷宮行為學檢測;D. 步態分析;F. 筑巢試驗
■ 神經元 CMA 缺陷導致蛋白質穩態的破壞
作者團隊發現,在 6 個月大的 L2A-/- 小鼠的海馬體中,出現了脂褐質和 K63 泛素化蛋白的積累 (兩個蛋白是溶酶體降解的靶蛋白),CKL2A-/- 小鼠的海馬體的錐體神經元中也發現了類似特征 (圖 5A-B)。同時 CKL2A-/- 小鼠皮質的免疫印跡分析顯示,氧化蛋白泛素化蛋白累積 (圖 5C-D),這些結果表明 CMA 缺失會導致神經元蛋白穩態的破壞。

圖 5. CMA 缺失會導致神經元蛋白穩態的破壞A. 海馬體中的脂褐素熒光檢測;B. K63 泛素化蛋白的檢測;C-D. 氧化蛋白和泛素化蛋白積累的檢測
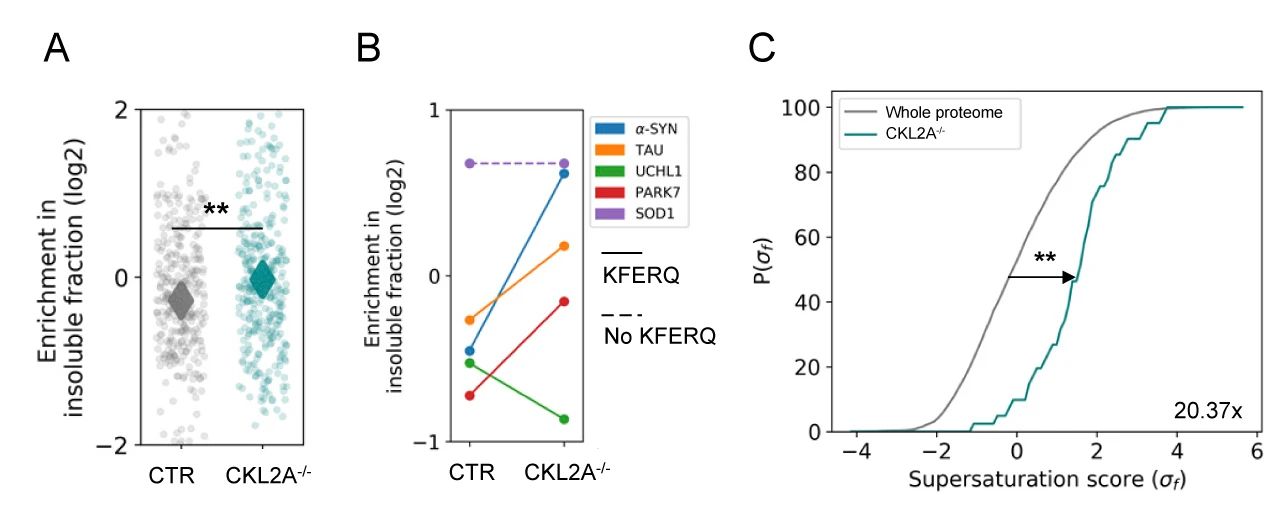
緊接著,研究者們分離 CTR 組和 CKL2A-/- 小鼠皮層 Sarkosy 不可溶蛋白,進行了定量蛋白組學的分析。實驗結果表明 CKL2A-/- 小鼠大腦聚集了大量不可溶蛋白,且這些蛋白 76% 含有 KFERQ 樣基序,原本易于聚集的帶有 KFERQ 樣基序的蛋白質 (例如 α-syn、tau、UCHL1 和 PARK7 等蛋白) 向不溶性蛋白的轉變增多 (圖 6B)。研究者們還分析了過飽和分數,發現 CKL2A-/- 小鼠的不溶性蛋白質中的過飽和分數顯著增加 (20.37 倍)。
圖 6. 神經元 CMA 被阻斷后蛋白質組的變化A. 總蛋白質和易于聚集的蛋白質的富集;B. 帶有 KFERQ 樣基序的蛋白質向不溶性蛋白轉變;C. 過飽和蛋白分數的增加
以上結果表明,在 CMA 缺陷時轉變為不溶性的蛋白質組是過飽和蛋白質組中的一部分,并且神經元 CMA 缺失會導致蛋白質組的破壞。
■ CMA 和巨自噬對神經元蛋白質變性的影響不同
下一步,研究者們在 CKATG7-/- 小鼠和 CKL2A-/- 小鼠模型中,通過比較蛋白質組學來闡明 CMA 和巨自噬對神經元蛋白質變性的特定作用。
不溶性蛋白質組的基因集富集和富集圖分析 (圖 7A) 結果表明,CKATG7-/- 小鼠和 CKL2A-/- 小鼠中發生變化的蛋白質組不相同。CKATG7-/- 導致細胞周期和泛素化蛋白酶體分解代謝過程相關的蛋白變化 (藍色箭頭指出),而與 CMA 缺陷與蛋白質運輸和代謝有關 (紅色箭頭指出)。
細胞外酸化率 (ECAR) 的測定結果表明,CKL2A-/- 神經元中糖酵解的顯著減少 (圖 7B),而且很多糖酵解酶也在 CKL2A-/- 小鼠的不溶性蛋白部分中增加,如丙酮酸脫氫酶 (PDH) (圖 7C)。

圖 7. 神經元蛋白質組不同亞群的變化分析
A. 不溶性蛋白基因集富集分析;B. 細胞外酸化率 (ECAR) 的測定;C: 糖酵解酶表達的減少
A. 不溶性蛋白基因集富集分析;B. 細胞外酸化率 (ECAR) 的測定;C: 糖酵解酶表達的減少
雖然已有報道阻斷巨自噬也會影響神經元糖酵解,但實驗結果顯示,L2A 和 ATG7 敲低對糖酵解特性的影響并不同。以上結果表明,CMA 缺陷神經元蛋白質組向不溶性蛋白轉變后導致的結果區別于巨自噬。
基于上面的研究,推斷:神經元 CMA 被直接阻斷后,不溶性蛋白的積累和神經元功能的改變,這可能增加神經退行性疾病的易損性并加速疾病進展。
研究者建立了 hTauP301L 過表達小鼠,結果表明:其神經細胞的 CMA 活性降低,CMA 斑點數目明顯減少 (圖 8A)。研究者還建立了 P301S tau 轉基因小鼠,在該模型中使用了 CA77.1 (AR7 的衍生物) 在體外激活 CMA 且不影響巨自噬 (圖 8B)。在體內,CA77.1 給藥使得原本“凌亂”的 PS19 小鼠的正常化 (圖 8C),并顯著減少了海馬、杏仁核和梨狀皮層中含有致病性 tau 構象的神經元的數量 (圖 8D)。

圖 8. CMA 的化學激活改善了 hTauP301L 和 PS19 小鼠的神經病理特征
A. hTauP301L 小鼠神經元 CMA 染色;B. CA77.1 體外激活 CMA;C. P301S tau 小鼠的行為測試;D. 海馬體免疫組化染色
A. hTauP301L 小鼠神經元 CMA 染色;B. CA77.1 體外激活 CMA;C. P301S tau 小鼠的行為測試;D. 海馬體免疫組化染色
總結:
這篇文章充分證明了分子伴侶自噬 (CMA) 對神經細胞穩態具有重要調節作用。
研究者們通過具有全身性和神經元特異性 CMA 阻斷的小鼠模型,證明了神經元 CMA 的缺失導致蛋白質毒性和神經元功能障礙。CMA 缺失還會使原本易于聚集的 KFERQ 樣基序蛋白質向不溶性蛋白轉變。
通過神經元特異性 CMA 和 ATG7 缺失小鼠模型,證明了 CMA 和巨自噬在調控神經元蛋白質穩態中與神經變性的亞蛋白質組并不相同。
| 分子伴侶介導的自噬相關產品 |
| AR7 體外特異性激活伴侶介導的自噬 (CMA) 活性,且不影響巨自噬。 |
| QX77 伴侶介導自噬 (CMA) 激活劑,AR7 的結構衍生物。QX77 誘導 Rab11表達上調。 |
| CA77.1 AR7 的衍生物,具有腦滲透性和口服活性的 CMA 的激活劑,可用于神經相關疾病的研究。 |
| Thioflavine S 熒光標記物,可染色淀粉樣斑塊,可用于阿爾茲海默癥等疾病的研究。 |
| Hoechst 33342 發藍色熒光的 DNA 染料,可通透過細胞膜。 |
| β-Amyloid 蛋白相關產品 |
| β-Amyloid (1-42), human TFA β-Amyloid (1-42), human TFA 是由 42 個氨基酸組成的肽,是構成老年斑和神經纖維纏結的主要成分,在阿爾茨海默病的發病機制中起關鍵作用。 |
| β-Amyloid (25-35) β-Amyloid (25-35) 是 β-淀粉樣蛋白的活性片段,可誘導阿爾茨海默病相關的神經毒性。 |
| β-Amyloid (1-42), rat TFA β-Amyloid (1-42), rat TFA 是由 42 個氨基酸組成的肽,有神經毒性作用,可用于阿爾茲海默癥的相關研究。 |
| β-Amyloid (42-1), human Amyloid β Peptide (42-1) (human) 是 β-Amyloid (1-42) 的無活性形式。可用作陰性對照。 |
| 巨自噬相關產品 |
| 自噬激活劑 包含 Rapamycin,MG-132 等多種有效的自噬激活劑。 |
| 自噬抑制劑 包含 3-Methyladenine (3-MA) ,Resatorvid (TAK-242) 等近 200 種有效的自噬抑制劑。 |
| 自噬化合物庫 收錄了 900+ 種自噬信號通路相關的產品,是研究自噬相關調控及疾病的有用工具。 |
參考文獻
1. Evripidis Gavathiotis, Ana Maria Cuerv, et al. Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome. Cell2021 May 13;184(10):2696-2714.e25.
2. Susmita Kaushik, Ana Maria Cuervo, et al. The coming of age of chaperone-mediated autophagy. Nat Rev Mol Cell Biol. 2018 Jun;19(6):365-381.
3. Esteban-Martı´nez, L., Sierra-Filardi, E., McGreal,R.S., Salazar-Roa, M, et al. Programmed mitophagy is essential for theglycolytic switch during cell differentiation.EMBO J. 36, 1688-1706.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com