miR-124-3p負調控Lamin A/C來調節循環拉伸過程中平滑肌細胞凋亡
血管平滑肌細胞 (VSMCs) 是動脈的主要細胞成分,是血管疾病的關鍵決定因素。 VSMC 的凋亡已被證明是高血壓環境中動脈重塑的重要過程。在全身性高血壓動脈重塑過程中,促進VSMC凋亡,細胞外膠原合成和降解失衡,導致血管壁膠原過度沉積。
在高血壓期間,機械循環牽張力(定義為血管壁隨著心動周期有節奏地擴張和松弛時細胞的重復變形)顯著增加。機械循環拉伸可誘導VSMCs 的表型轉換、增殖、凋亡和遷移。許多機械響應信號通路已被證明受循環拉伸的影響,包括 PI3K/Akt、NFκB、和 MAPK 通路等。
此外,細胞質和細胞核中的細胞骨架蛋白也對不同程度的循環拉伸有反應。例如,循環拉伸誘導微絲的調整和重組。研究表明,核纖層蛋白 A 和 emerin 是細胞核中重要的細胞骨架蛋白,它們對循環拉伸和剪切應力都有反應。
核纖層蛋白(Lamins) 是核中間絲蛋白,構成核纖層的結構成分,核纖層是內核膜下方的蛋白質網絡,決定核的形狀和大小。在哺乳動物細胞中發現了兩種類型的核纖層蛋白:A 型核纖層蛋白,包括核纖層蛋白 A、C、A∆10 和 C2,由單個基因 (Lmna) 編碼,在分化細胞中發育調節和表達;B 型核纖層蛋白,包括核纖層蛋白 B1 和 B2/B3,由兩個不同的基因編碼,并在所有細胞中表達。在機械反應過程中,核纖層蛋白 A 和 C (lamin A/C )是已被廣泛研究的應力敏感分子。盡管研究已經證明不同類型的機械刺激可以調節 lamin A/C,但這些過程中涉及的詳細機制仍不清楚。
基于此,上海交通大學機械生物學與醫學工程研究所、北京航空航天大學生物力學與力學生物學教育部重點實驗室的專家學者進行了研究,初步表明,泛素降解途徑的抑制部分逆轉了異常循環拉伸對 lamin A/C 的抑制。然而,這個逆轉過程并不完整,這表明還有其他調控機制影響了 lamin A/C 的表達。
因此,研究人員進一步研究,試圖證明在異常循環拉伸下 lamin A/C 表達改變的機制,并進一步檢測這種表達改變在 VSMC 凋亡中的作用。相關研究成果發表在 Acta Physiologica 題為《Lamin A/C negatively regulated by miR-124-3p modulates apoptosis of vascular smooth muscle cells during cyclic stretch application in rats》。
實驗結果:
病理性循環牽張力抑制Lamin A/C的表達并誘導VSMCs凋亡
機械周向應力會因高血壓而顯著增加,這會導致彈性血管發生更強烈的變形。使用循環牽張力加載系統,在體外對VSMCs 施加不同幅度的循環拉伸。
與5% 的循環拉伸(模仿正常張力的生理拉伸)相比,15% 的循環拉伸(模擬高血壓的病理拉伸)顯著增加了VSMCs的凋亡,這是通過Annexin V/PI染色(圖1A)和裂解的半胱天冬酶 3 ELISA(圖1B)檢測到的。
此外,還研究了不同程度循環拉伸后 lamin A/C 的蛋白表達情況。與5%-CS相比,15%-CS降低了lamin A(在6、12和24小時)(圖1C)和lamin C(在24小時但在6或12小時沒有)(圖1D)的表達。
這些結果表明病理性升高的循環拉伸誘導了 VSMC 細胞凋亡并抑制了 lamin A/C蛋白的表達。
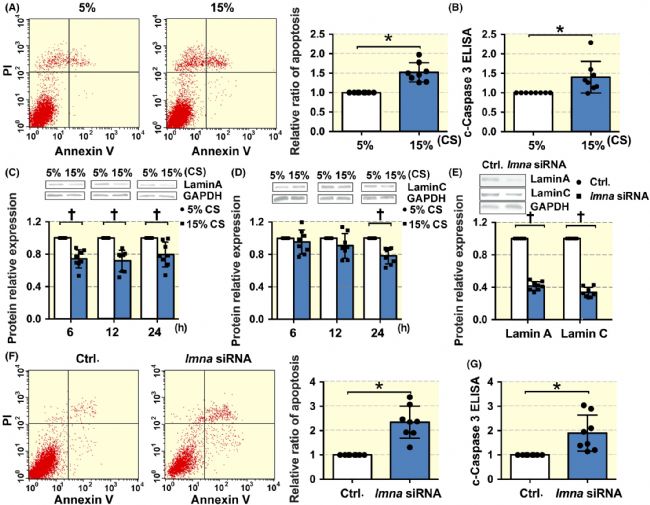
圖 1
抑制 lamin A/C 的表達可誘導VSMCs的凋亡
由于病理性循環拉伸下lamin A/C表達的改變伴隨著細胞凋亡的變化,于是檢測lamin A/C是否參與了凋亡的調控。
在靜態條件下,使用特異性siRNA降低lamin A/C 的表達(圖1 E)。靜態條件下,敲低Lamin A/C顯著增加VSMCs的凋亡 (圖1 F、G)。
總之,對拉伸作用下 lamin A/C 表達和VSMC凋亡的研究結果表明,病理性循環拉伸對 lamin A/C 的抑制可能有助于調節VSMC凋亡的。
lamin A/C表達的降低不受轉錄或自噬的調控
由于 lamin A/C 的蛋白表達在 15%-CS 下降低,實驗隨后探索了該過程中的潛在機制。雖然初步實驗揭示了泛素降解途徑在該過程中的部分作用,但進一步檢測了 lamin A/C 表達的詳細調控機制。
首先,檢測了不同程度的循環拉伸對 lamin A/C 的 mRNA Lmna 表達的影響。結果表明,在6、12和24小時,5%-CS和15%-CS組間的Lmna表達無顯著差異(圖2A)。這一發現表明病理性循環拉伸可能不會改變 lamin A/C 的轉錄。
此外,還探索了自噬,一種參與lamin B 降解的機械響應性蛋白降解機制,對lamin A/C 表達的影響。兩種自噬抑制劑 Baf 和 CQ 均顯著抑制了 VSMCs 中的自噬(圖2 B、C、F),但對 lamin A/C 的蛋白表達沒有顯著影響(圖2 D、E、G、H )。然后,檢測了 lamin A/C 表達的可能的轉錄后調控機制。
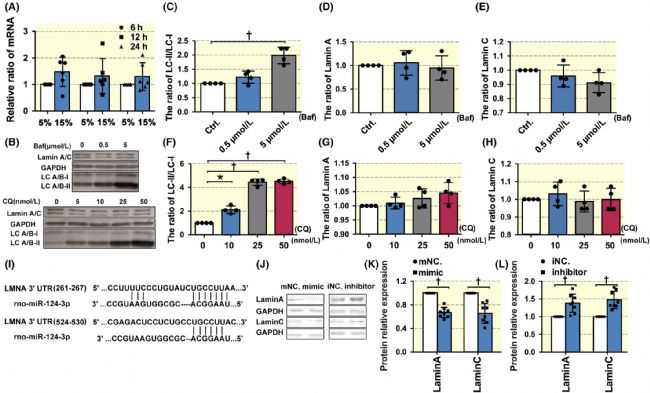
圖 2
miR-124-3p降低lamin A/C的表達
MiRs 是重要的內源性非編碼 RNA 分子,通過靶向特定的 mRNA 并誘導其降解或翻譯抑制來負調節蛋白質表達。為了識別 lamin A/C 調節中可能的 miRs,對三個在線數據庫進行搜索。結果表明,miR-124-3p在Lmna 3'UTR中有兩個預測的結合位點(圖2 I),說明miR-124-3p可能負調控lamin A/C 的表達。
隨后,miR-124-3p 在 VSMCs 中分別使用特定的模擬物或抑制劑過表達或敲低。蛋白質印跡分析結果表明,miR-124-3p模擬物顯著降低 lamin A/C的蛋白質表達(圖2 K),而抑制劑增加了lamin A/C水平(圖2 L)。這些結果表明 miR-124-3p 在 lamin A/C 表達的調節中起重要作用。
MiR-124-3p 在 Lmna 的 3'UTR 有兩個結合位點
使用雙熒光素酶報告基因系統評估 miR-124-3p 對 Lmna 3'UTR 的兩個獨立靶位點的結合和抑制能力。結果表明, Lmna 3'UTR 中的兩個靶向位點在 miR-124-3p 下調 lamin A/C 蛋白的表達中很重要。
然后檢查了 miR-124-3p 對 VSMC 凋亡的影響,結果顯示,miR-124-3p 模擬物顯著加速了 VSMCs 的凋亡,抑制物減弱了VSMCs的凋亡。
以上結果表明,miR-124-3p通過靶向Lmna 3'UTR上的兩個位點負調控lamin A/C的表達,進而促進VSMCs的凋亡。
抑制miR-124-3p可逆轉循環牽張引起的Lamin A/C表達和VSMC凋亡
實驗探討了 miR-124-3p 是否具有機械敏感性,,以及在循環拉伸過程中是否參與調控 lamin A/C 表達和 VSMC 凋亡。與暴露于 5%-CS 相比,暴露于 15%-CS 6、12 和 24 小時顯著增加了 miR-124-3p 的表達(圖3 A),這表明 miR-124-3p 也是一種機械敏感性分子。與對照組相比,miR-124-3p 抑制劑在 5%- 和 15%-CS 條件下均降低了 VSMCs 的凋亡(圖3 B、C、D),同時增加了 lamin A/C 的蛋白表達(圖3 E、F)。
這些結果表明 miR-124-3p-lamin A/C 通路參與了 15%-CS 促進的 VSMC 凋亡。
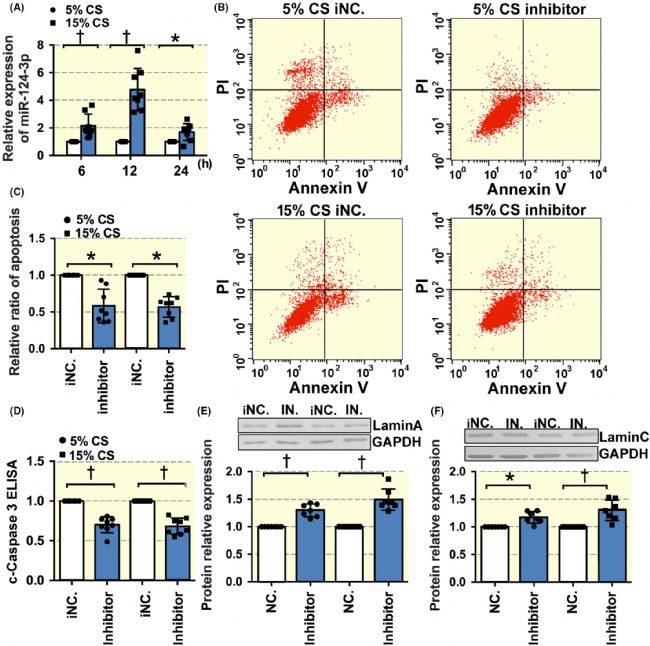
圖 3
lamin A/C 的下調可調控 VSMCs 中各種 TFs 的激活
據報道,核被膜 (NE) 蛋白調節 DNA 合成、染色質組織和基因轉錄。因此,使用 IPA 生物信息學軟件尋找可能與 lamin A/C 和 emerin 相互作用的潛在下游轉錄因子。首先發現了4個由lamin A/C和emerin共同調控的轉錄因子,然后通過蛋白質/DNA微陣列,發現lamin A/C或emerin的siRNA激活變化均超過2倍。
這些發現表明 lamin A/C 和emerin可調節TFs的活性,TFs可能參與了VSMC凋亡的調控。
高血壓在體內誘導miR-124-3p的表達并抑制lamin A/C的表達
使用腹主動脈縮窄高血壓模型,在體內探索 VSMCs 的變化。最終結果顯示,miR-124-3p/lamin A/C可能參與了高血壓引起的異常循環牽張誘導的VSMCs凋亡。
實驗結論:
總之,這項研究表明 NE 蛋白 lamin A/C 是 VSMCs 中的機械敏感分子。病理性升高的循環拉伸通過上調 miR-124-3p 抑制 lamin A/C 的表達,進而可能調節不同 TFs 的激活并最終影響 VSMCs 的凋亡。這些結果提供了證據,表明循環拉伸通過 NE 蛋白介導的機制調節 VSMC 的功能,并闡明了核骨架蛋白在機械轉導中的作用。
該研究可能為理解高血壓 VSMC 功能障礙的機制提供新的見解,并可能為在生理和病理上維持 VSMC 穩態提供一個潛在的靶點。
參考文獻:Bao H, Li HP, Shi Q, Huang K, Chen XH, Chen YX, Han Y, Xiao Q, Yao QP, Qi YX. Lamin A/C negatively regulated by miR-124-3p modulates apoptosis of vascular smooth muscle cells during cyclic stretch application in rats. Acta Physiol (Oxf). 2020 Mar;228(3):e13374. doi: 10.1111/apha.13374. Epub 2019 Sep 27. PMID: 31495066.
小編旨在分享、學習、交流生物科學等領域的研究進展。如有侵權或引文不當請聯系小編修正。微信搜索公眾號“Naturethink”,學習更多關于細胞牽張拉伸培養相關知識!