服務描述
制作原理
制作轉基因鼠最常用的一種方法是DNA原核顯微注射。DNA原核顯微注射是指將外源DNA通過顯微注射的方法注射到受精卵的原核內,注射DNA整合到大(小)鼠受精卵的基因組中,并穩定遺傳給后代。 賽業所使用的PiggyBac系統DNA顯微注射,制備的轉基因鼠基因表達陽性率為常規質粒DNA顯微注射的2倍以上!
PiggyBac系統打造高效轉基因——技術原理:
PiggyBac (PB) 系統是利用PB轉座子特有的“剪切和粘貼”機制,使DNA片段在載體和基因組之間“自由”的轉移,從而有效介導外源DNA片段對基因組的整合。轉座時,轉座酶有效的識別特異的轉座子序列(ITRs),與轉座子末端結合形成短暫的發夾結構,“剪切”后脫離,“粘貼”至基因組的TTAA位點。Cyagen實驗數據表明,PiggyBac系統基因表達陽性率為常規質粒DNA顯微注射的2倍以上!
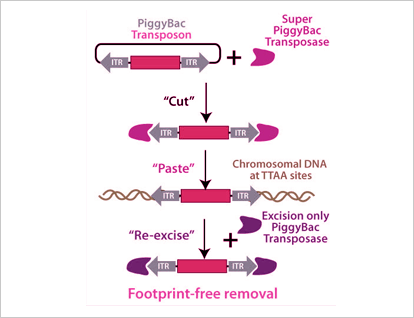
PiggyBac (PB)系統五大優勢:
1、更高的整合效率;
2、更高的目的基因表達概率;
3、更大的目的片段的插入;
4、更“精確”拷貝數的插入;
5、可自由移除插入片段。
服務流程和周期

動物品系
C57BL/6小鼠:目前公布的小鼠基因組測序結果來源于C57BL/6小鼠品系。該品系小鼠模型已廣泛應用于腫瘤、免疫、遺傳學等方面的研究, 并已成為發表文章的首選小鼠品系。
FVB小鼠:原核大、清晰、近交品系,基因型比較單一;具有易于原核注射的優點。
SD大鼠:適合用于研究心血管、神經系統等器官發育的常用模式動物品系。
轉基因大(小)鼠類型
1、過表達轉基因大(小)
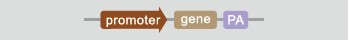
構建上述常規的帶有啟動子和目的基因的表達載體, 利用原核顯微注射的方法將表達載體注射到小鼠受精卵中。通過構建廣泛性/組織特異性/誘導性等不同的啟動子,實現轉基因在小鼠組織廣泛性/特異性/特定條件下等的表達,達到對目的基因功能的研究目的。
2、RNAi轉基因大(小)鼠
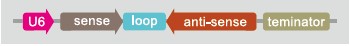
通常采用U6/H1驅動shRNA表達,設計靶序列構建shRNA載體,利用原核顯微注射的方法將shRNA載體注射到受精卵中。在基因表達的過程中,通過shRNAi的干擾作用,達到對目的基因表達的沉默抑制,實現基因功能的研究。
3、microRNA轉基因大(小)鼠

構建上述兩種microRNA過表達和下調載體,通過原核顯微注射將載體注射到受精卵中,通過基因表達,實現microRNA過表達或者下調。
4、可誘導性/組織特異性轉基因大(小)鼠

將構建的廣泛表達啟動子-lox-stop-lox-轉基因載體通過顯微注射制備組織特異性轉基因大(小)鼠模型,轉基因在正常情況下并不表達, 只有與相應的組織特異性表達Cre/CreERT2小鼠雜交后,因Stop終止序列在特定的組織中被去除,從而達到轉基因在誘導性/特定組織中特異性表達 的目的。
5、BAC轉基因大(小)鼠
Bacterial artificial chromosomes(BACs)是處理大片段DNA的重要工具。由于其完整性和保真度,可以更好的解釋轉基因的重要功能。因此,為了研究完整的時空特 異性基因表達、基因結構及調控元件等,可以將BAC直接進行原核顯微注射(約幾十到幾百Kb)或者將其改造后注射在小鼠或大鼠的受精卵中,以獲得轉基因鼠。
建系原則與流程
1、原核顯微注射導入的目的基因是將目的基因隨機整合到小鼠或者大鼠的基因組,因此首代轉基因鼠(F0)將會有不同的整合位點。整合基因的拷貝數可能在不 同的首代轉基因鼠中也不同。因此,每只F0代鼠需要作為一個獨立的譜系研究,并且與其它F0代鼠分開進行繁殖。由于外源基因一般只整合在二倍體動物的其中 一條染色體上,屬于半合子,其后代只有一部分個體帶有整合的基因,需要進行篩選鑒定。
2、 原核顯微注射獲得PCR陽性F0代雜合子鼠。
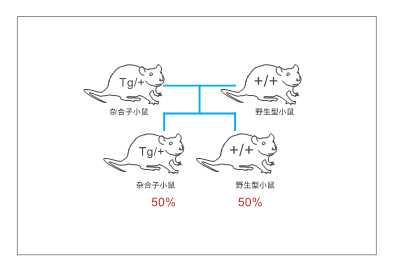
3、 F0代鼠達到性成熟后(8周)與野生型鼠進行交配,獲得F1代鼠。
4、 對交配獲得的F1代鼠進行基因型鑒定,理論上,F1代鼠中有50%為轉基因雜合子鼠,50%為野生型鼠。
注意事項:
1)每只F0代鼠基因型都不一樣,不能進行F0之間的自交,只能先與野生型交配,篩選出基因型一致的F1。(假如F0代有多個位點的外源基于整合,F1還有可能有多種基因型)。
2) 獲得F1鼠后,可以進行蛋白表達鑒定,優先篩選出表達的鼠后再進行后續的傳代和保種。



