同立海源推出GMP級抗人CD16單克隆抗體免費試用活動
一、摘要
一百多年前,“魔術子彈”學說首次提出了具有靶向特異性的抗體可以用來治療疾病。此后,隨著單克隆抗體制備技術的成熟,以及癌癥血清療法的發展,靶向腫瘤抗原的治療性抗體開始進入臨床,至今已有20余種抗體藥物用于癌癥的治療。近兩年,以免疫檢查點蛋白拮抗劑、雙特異性抗體、抗體藥物偶聯藥物等為代表的新一代抗體藥物,在治療惡性腫瘤上不斷取得突破性進展。
“免疫逃逸”是腫瘤發生過程中的重要標志和主要機制。腫瘤的免疫療法 (Immunotherapy) 是通過增強機體對癌細胞的識別能力,利用機體自身的免疫能力對腫瘤進行清除【1】。與手術、化療、放療等傳統療法相比,腫瘤免疫療法具有腫瘤靶向性好、療效持久,臨床副作用小等優點。
二、CD16對NK細胞的影響
NK細胞(自然殺傷細胞)是固有免疫的主力軍,體外NK細胞的分化過程可以通過流式細胞儀進行檢測。NK細胞起源于CD34+造血干細胞(CD34+HSCs),其分化主要經歷三個階段:NK前體細胞(NKP),未成熟的NK細胞(iNK)和成熟NK細胞(mNK)。CD161的首次出現意味著細胞進入NKP階段;隨著活化受體NKp44的表達,iNK逐漸形成;最后,CD16和殺傷細胞免疫球蛋白樣受體(KIR)的表達標志著NK細胞進入成熟階段。這也就說明,CD16對于NK細胞的成熟起著決定性的作用。
其實,最先發現的細胞表面抗原就是CD16,CD16即FcγRⅢ,為分子量為50000~70000的糖蛋白,屬Ig超家族成員,已知參與抗體依賴性的細胞毒性(ADCC)作用,其最顯著的特征在于膜受體負責觸發的裂解是由NK細胞完成的。CD16作為低親和力受體對于一些IgG的Fc部分,與CD3ζ的Fcε關聯受體I(Fc的εRI)γ鏈結合,共同參與信號轉導。NK細胞上交聯的CD16直接導致細胞內Ca+水平的增加和一系列的類似于T細胞受體激活的級聯生化反應。有文獻報道,CD16對人NK細胞作為裂解受體介導直接殺傷某些病毒感染和腫瘤細胞的過程,是依賴于抗體的緊密結合來實現的。
此外,NK細胞表面還有多種重要抗原,比如CD56(與纖維生長因子-1——FGFR-1結合),CD2(淋巴細胞相關分子2,LFA-2),CD58(LFA-3),CD11a/CD18(LFA-1)等。
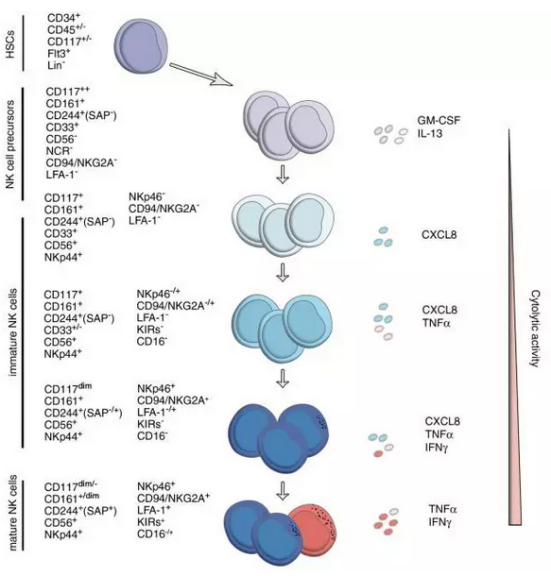
NK細胞的分化
此外,設計以NK細胞表面活化受體CD16和NKG2D為靶點的雙特異性分子,可以靶向NK細胞識別并殺傷腫瘤細胞。(雙特異性分子被設計用來識別激活NK細胞受體結合另一端的腫瘤抗原,以使NK細胞殺滅過度表達這些抗原的腫瘤細胞)
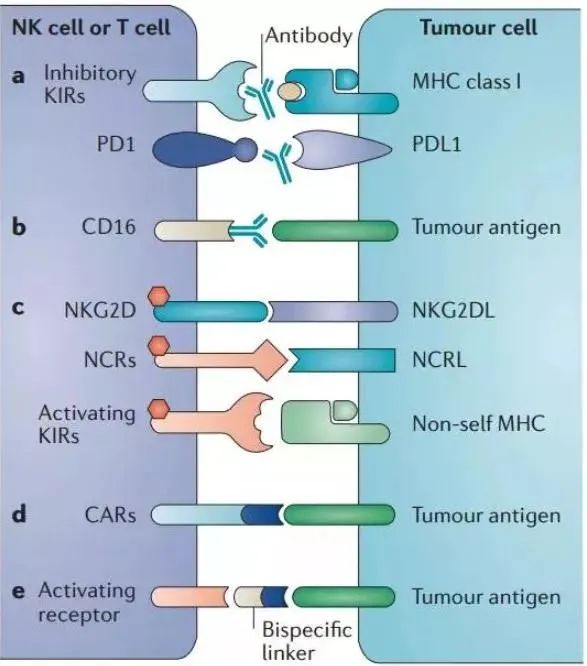
利用NK細胞潛能的治療方法示意圖
三、如何增強NK細胞抗癌效力
總的來說,利用NK來抗擊腫瘤的方式主要概括為三點:即激活NK細胞、解除NK細胞的免疫抑制、控制NK細胞毒性。NK細胞作為繼T細胞用于癌癥治療的第二大免疫細胞有著非凡的地位,雖然NK細胞療法的開發可以參照現有的T細胞療法,但同時也應注意到,這兩種免疫細胞有不同的作用機制,要想真正將NK細胞的抗癌效力發揮出來,還需要對其分子特征和功能的進一步探索和驗證。
2021年5月,意大利科學家Capuano等在Cancer雜志上發表的一篇綜述上指出,CD16觸發的ADCC細胞毒效應和分別由NK細胞、單核/巨噬細胞介導的吞噬作用是mAbs介導腫瘤細胞殺傷并達到治療效果的主要免疫依賴機制。目前,針對激活和/或抑制NK細胞CD16受體,以微調mAbs抗腫瘤反應的策略已經在積極研究,并將在未來進一步推進【2】。
增強NK細胞對mAbs反應的策略主要有:①改善單抗與CD16相互作用。mAbs Fc區域的基因改造或糖工程已被關注并陸續開發,以調節它們與Fcγr家族的激活和抑制成員的相互作用。Obinutuzumab是首個獲準臨床使用的糖工程單抗,與利妥昔單抗相比,增加了對CD16的親和力,從而誘導更強的NK細胞介導的ADCC作用;②合成雙特異性殺傷接合子(BiKEs)或三特異性殺傷接合子(TriKEs),有效地將NK細胞的細胞毒性導向腫瘤細胞。 這種小結構(50-75 kDa)通常由一個抗CD16抗體的單鏈可變片段(scFv)連接到一個(BiKE)或兩個(TriKE)腫瘤抗原特異性抗體的scFv。 通過這些結構允許高親和性的CD16+NK細胞和腫瘤細胞連接,從而克服了受體多態性的局限性,在生物分布、低免疫原性和反應速度方面顯示出相對于標準治療性單克隆抗體的優勢。如CD16xCD133雙特異性受體具有重要的治療潛力,因為它能夠靶向耐藥CD133+癌癥干細胞群體。而就像以MDSC為靶點的CD16xCD33雙特異性受體一樣,這些結構的另一個附加價值體現在它們能夠誘導NK細胞殺傷TME中免疫抑制成分;③放大NK細胞對CD16參與反應的策略。通過配體識別或mAbs結合激活NK受體的互補信號,可能增強NK細胞效應對治療性mAbs調理腫瘤細胞的功能。NK細胞接合子(NKCEs),由兩個靶向NK激活受體NKp46的單抗片段和一個特定的腫瘤抗原組成,并與一個優化了CD16結合的Fc片段結合,被證明可以促進腫瘤清除和改善NK細胞腫瘤浸潤,在小鼠體內模型中,這些結構比完整的mAbs更有效;④另一方面,CD16依賴的NK細胞激活和效應功能受MHC-I類特異性和非特異性抑制受體的控制。在臨床前模型中發現,通過PD-1或TIGIT阻斷NK細胞中的免疫檢查點,可進一步增強曲妥珠單抗和西妥昔單抗觸發的NK細胞功能。
四、學術論證
2021年8月,Reusing S B等在知名學術期刊《Cancer Immunology, Immunotherapy》上發表了他們關于CD16XCD33雙抗的研究報道【3】。

急性白血病是兒童中診斷出的最常見的惡性腫瘤,約占兒童癌癥診斷的30%,絕大多數(80%) 患有急性淋巴細胞白血病(ALL),而其余的被診斷為急性髓性白血病(AML)。其中,大約25%的雙表型或雙系ALL表達髓系特異性抗原CD33,因此,CD33+白血病患者標志著一個高危人群,迫切需要新的策略來促進免疫系統克服惡性腫瘤而不增加進一步危及生命的毒性。為了更有效地將NK細胞引導至白血病靶點,研究者設計了一種完全人性化的雙特異性殺傷細胞接合器。
CD16xCD33 BiKE包含兩個抗體片段,第一個識別CD16 (FcγRIII),第二個針對骨髓分化抗原CD33,它們共同觸發抗體依賴性細胞介導的細胞毒性。針對CD33+靶標的CD16信號傳導是NK細胞特異性的,并且專門針對CD33+細胞,因此,抗體通過CD16直接觸發NK細胞活化,顯著增加NK細胞的細胞毒性和細胞因子的產生。此外,通過這種方式,CD16xCD33 BiKE已被證明有可能克服KIR信號傳導的抑制作用,并改善NK細胞介導的成人AML原始細胞裂解。該研究評估了CD16xCD33 BiKE是否可以增強NK細胞對CD33+原發性兒童ALL和AML細胞的激活。
2021年9月14日,來自美國明尼蘇達大學醫學系的Frank Cichocki團隊和Jeffrey S. Miller團隊在Cell Stem Cell雜志上合作發表了一篇題為 Harnessing features of adaptive NK cells to generate iPSC-derived NK cells for enhanced immunotherapy 的文章【4】,該團隊報告了一項三基因編輯的iNK細胞產品,來自巨細胞病毒血清陽性供體的適應性NK細胞亞群表現出低水平的CD38,高水平的NAD+以及更高的抗氧化應激能力。基于此,一方面可以通過在轉導hnCD16的iPSC中敲除CD38來設計iNK細胞(hnCD16/CD38KO iNK)以獲得代謝增益效果,同時也能避免由治療性抗CD38抗體達雷木單抗介導的NK細胞“自相殘殺”行為。這種iADAPT NK即使在沒有外源性細胞因子的情況下也能在體內持續存在并發揮作用,并且可以與治療性抗體結合以增強腫瘤靶向性。

結語:CD16分子作為一個經典靶點,是許多藥物開發的候選位點。根據全球最大臨床試驗注冊網站數據顯示,目前全球范圍內針對CD16分子開展的臨床試驗有近200項,正在開展臨床試驗的項目有57項,這些臨床試驗主要涉及腎移植及終末期腎病治療、新冠病毒感染治療、實體瘤治療、心血管疾病治療、呼吸道感染治療等方向,涉及到一二十款藥物的開發。對于CD16這樣一個老靶點而言,在藥物開發領域,用一句當下流行的網絡詞語來概括一下:經不經典我不管,科學家們都愛這一款.....
北京同立海源生物十余年專注細胞和基因治療(CGT)領域上游GMP級核心原料試劑研發生產,擁有哺乳動物細胞表達蛋白質工程平臺,公司生產的抗人單克隆抗體——CD16,運用先進的雜交瘤技術,篩選出穩定高產的雜交瘤細胞株,以及特有的基因克隆技術導入到CHO細胞穩轉表達生產,助力生命科學研究。
掃碼免費領取試用裝
1、試用產品信息:
英文名稱:Anti-human CD16 mAb
產品貨號:GMP-TL201
試用規格:100μg
2、時間:即日起-2022年8月31日;
3、申請要求:申請信息完整,能夠近期開展實驗;

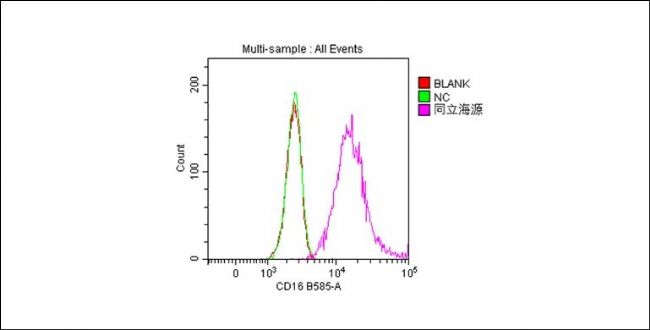
驗證數據
高純度HPLC和SDS-PAGE驗證
參考文獻:
[1]Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell, 2011, 144(5): 646-674.
[2]Cristina Capuano , Chiara Pighi, Simone Battella, et al. Harnessing CD16-Mediated NK Cell Functions to Enhance Therapeutic Effificacy of Tumor-Targeting mAbs.Cancers 2021, 13, 2500.
[3]Reusing S B , Vallera D A , Manser A R , et al. Correction to: CD16xCD33 Bispecific Killer Cell Engager (BiKE) as potential immunotherapeutic in pediatric patients with AML and biphenotypic ALL[J]. 2021.
[4]Woan K V , Kim H , Bjordahl R , et al. Harnessing features of adaptive NK cells to generate iPSC-derived NK cells for enhanced immunotherapy. 2021.
- 默瑞生物VivoMatter基質膠產品試用活動進行中
- 柏恒科技推出超微量分光光度計BGNANO免費試用活動
- 突破關稅壁壘,中喬新舟國產細胞培養基免費試用
- 艾貝泰邀您試用Countleader FL 2000細胞計數儀
- QD中國推出高分辨顯微鏡mIRage樣機免費體驗活動
- 本生生物推出胎牛血清試用活動,開蓋即有獎
- 加拿大AVESTIN(奧威斯汀)C3高壓均質機樣機免費試用
- 安捷倫SureSelect Max文庫制備方案上市,免費試用
- 艾貝泰MesenPlify™ sXF 干細胞培養基,試用已開啟
- 諾杰聯合Micronova推出CST潔凈室膠帶免費試用
- 免費試用—奧豪斯pH電極新品搶鮮用
- 浚真生命邀您試用CytScop®Pro智能細胞計數儀
- 上海納洛捷納米藥物LNP微流控制備儀開學季免費試用
- 知禾泰克邀您免費試用人源化CD3單克隆抗體OKT3
- 浚真生命推出CytScop®細胞計數儀免費試用活動
- GelNEST™基質膠助力應對貿易壁壘下的科研不確定性
- 拉曼技術在未來醫學中的應用醫工融合沙龍成功舉行
- 博鷺騰試劑2025首次大促銷開啟,超多優惠等你來
- 中喬新舟開學優惠:細胞實驗套裝980元,培養基折扣等
- 中喬新舟限時促銷:買細胞就送支原體檢測試劑盒
- 華威中儀試劑盒年末限時優惠來襲,儲值享好禮
- 美德聲推出新品重組細胞系用于生產單克隆血型試劑
- 百螢小麥胚芽凝集素探針染料8折優惠,買即贈鼠標墊
- 上海惠誠生物成為安普未來恒溫擴增試劑盒代理商
- 雙11科研狂歡促銷,逐典攜手埃澤思下單滿額雙重好禮
- MCE 第三屆細胞攝影大賽圓滿落幕,評選結果公布
- MCE教師節直播:細胞凋亡的機制、標志物與檢測方法
- 百螢SO Green 520WS單線態氧探針促銷,買即送京東卡
- 中喬新舟開學特惠活動:細胞系5折無需捆綁輕松購
- 上海逐典生物參展2024 IDC第三屆新藥研發影響力大會






