上海伯豪客戶發現吉西他濱耐藥性新機制

研究背景
乳腺癌是世界范圍內女性最常見疾病,目前乳腺癌治療會結合手術和多種輔助治療手段。然而在乳腺癌治療中,化療藥物耐藥是治療一大障礙。因此深度理解藥物抵抗、代謝機制實施個性化藥物治療非常重要。吉西他濱(Gemcitabine; 20,20-difluorodeoxycytidine, dFdC)是FDA批準的治療后復發或轉移病人以及蒽環霉素輔佐化療失敗病人的一線藥物。90%以上吉西他濱服用都是由胞苷脫氨酶將其轉化為2’-deoxy-2’,2’-difluorouridine (dFdU)導致失活。最近研究表明吉他西濱代謝通路中的基因與吉他西濱藥物抵抗相關。另外,有研究表明,miRNA在化療藥物抵抗過程中起著關鍵作用。然而,乳腺癌中吉他西濱藥物抵抗潛在的分子機制尚未闡述清楚。該研究中miRNA芯片(Agilent Technology, Austin, TX)以及mRNA芯片(Affymetrix, Santa Clara, CA)服務由上海伯豪生物完成。
研究結果
1. 吉西他濱抗性細胞構建及其性質描述
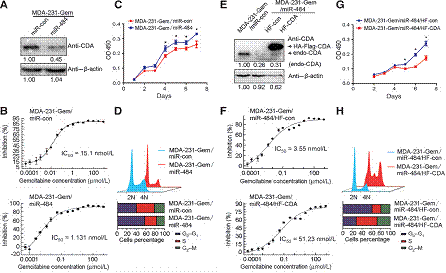
為了揭示吉西他濱在乳腺癌中抗藥性的分子進化機制,研究者通過將MDA-231細胞系暴露于12個逐漸增加吉西他濱藥物濃度產生出了吉西他濱抗藥細胞系MDA-231-Germ。MDA-231-Germ 的IC50值比親代細胞系MDA-231高9倍。用吉西他濱治療時MDA-231-Germ克隆細胞數目也顯著高于MDA-231。為了研究吉西他濱抗性基因,分別對親代細胞以及耐藥性細胞用芯片技術獲得mRNA表達譜,并進行GO富集分析發現激活的通路都與藥物代謝相關。以上結果說明研究者已經成功建立了吉西他濱抗性細胞系MDA-231-Gem cells。
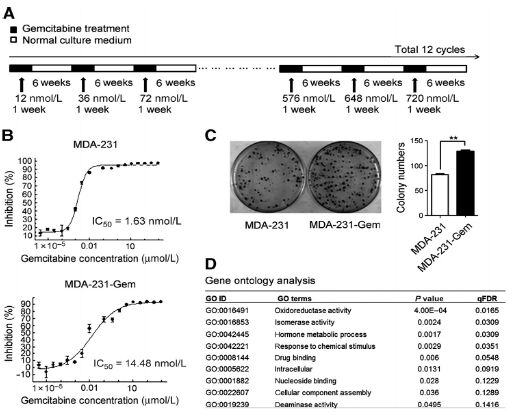
2. 提高CDA表達能夠促進乳腺癌細胞吉西他濱耐藥性
基于以上mRNA表達譜芯片分析發現一些重要的吉西他濱代謝酶主要集中于一個代謝通路中。其中能夠通過脫氨基作用失活吉西他濱的CDA在MDA-231-Gem細胞中上調。此外,CDA在MDA-231和MDA-436表達,但是在MCF7, ZR-75-30 ,MDA-468, and Hs-578T細胞系中幾乎不表達。而與芯片分析結果一致,CDA在MDA-231-Germ與其他細胞系相比高表達。細胞毒性實驗表明,過表達CDA的乳腺癌細胞系具有更高的IC50值。抑制CDA表達能夠降低乳腺癌細胞系對吉西他濱的藥物抗性。以上結果表明CDA表達與乳腺癌細胞系對于吉西他濱治療敏感性非常相關。

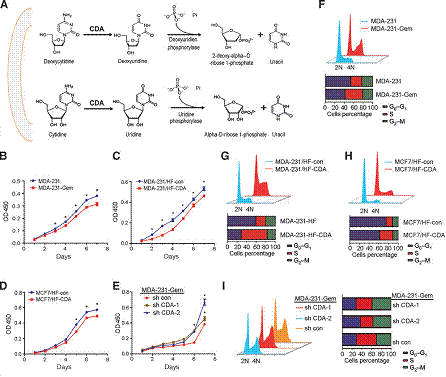
3. CDA抑制乳腺細胞增殖導致細胞循環重分配
細胞增殖實驗表明CDA表達量高的MDA-231-Gem細胞比其親代細胞增殖速率慢。CDA過表達能夠抑制MDA-231和MCF-7細胞增殖,CDA抑制能夠促進MDA-231細胞增殖。因此,可以得出結論CDA能夠抑制乳腺細胞增殖。由于CDA在嘧啶轉換為尿苷過程其重要調控作用,因此可能會影響核酸池平衡致使復制速率減慢。因此通過檢測細胞周期分布發現S期細胞比例在MDA-231-Gem中比親代細胞明顯增加。在MDA-231和MCF-7導入外源性CDA導致S期細胞比例增加。當在MDA-231-Gem導入CDA靶向的shRNA,S期富集現象逆轉。以上結果表明CDA在調控細胞周期重分布以及復制過程發揮重要作用。
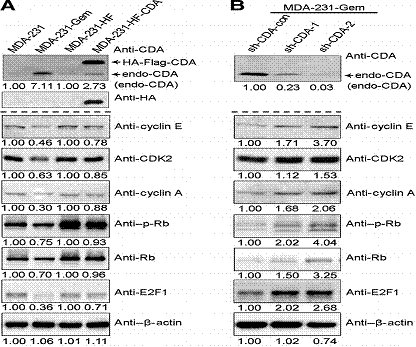
4. Cyclin E–CDK2復合物及其相關分子參與CDA介導的細胞周期重分布
Cyclin E–CDK2在控制G1-S細胞周期中起到重要作用,因此本文用Western blot實驗分析cyclin E–CDK2 complex,當CDA在MDA-231-Germ中高表達時cyclin E和CDK2下調。而沉默CDA,cyclin E–CDK2復合物表達增加。與cyclin E類似cyclin A表達也與CDA呈相反趨勢。cyclin E–CDK2復合物會導致Rb磷酸化不能與轉錄因子E2F結合使下游基因轉錄度過G1-S期。磷酸化Rb,Rb表達以及E2F表達與cyclin E–CDK2復合物類似說明CDA水平可能會降低cyclin E–CDK2復合物表達抑制下游通路活性。以上結果說明cyclin E–CDK2復合物以及其相關的分子參與了CDA誘導的細胞周期重分布。
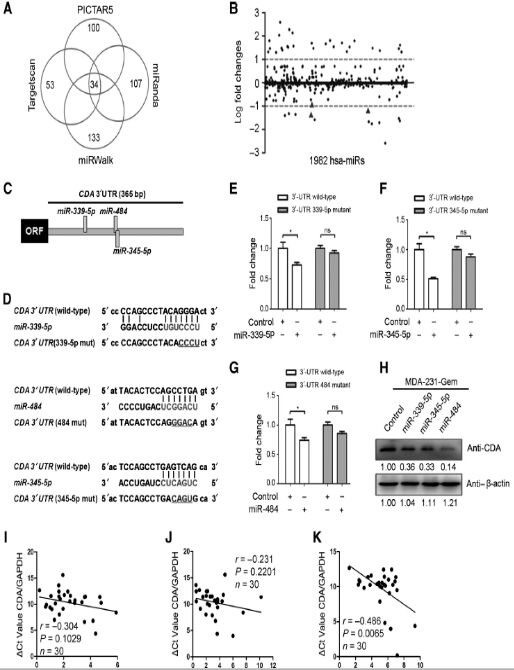
5. miR484作為轉錄后調控子下調CDA表達
首先本研究采用多種算法預測CDA的靶基因,得到34個候選miRNA至少被四個算法預測到。34個候選miRNA中有3個在MDA-231-Gem和親代細胞差異表達。熒光素酶報告試驗證實三個miRNA可以和CDA結合。western blot發現miR-484能有效抑制CDA表達。3個miRNA中只有miR-484與CDA表達顯著負相關。以上實驗說明miR-484可能通過直接靶向CDA 3’-UTR使其表達下調。
6. miR-484/CDA調節乳腺癌細胞吉西他濱抗性、細胞增殖以及細胞周期重分布
以上結果表明CDA可能是miR-484靶基因,為了進一步驗證,過表達miR-484能夠引起CDA表達下降,其所表現出的結果和引入shRNA類似。進一步,如果CDA是miR-484靶基因,那么在miR-484表達的細胞中引入CDA應該可以抵消miR-484引起的表型。結果正如預料的一樣,說明miR-484能夠靶向CDA調控下游通路。
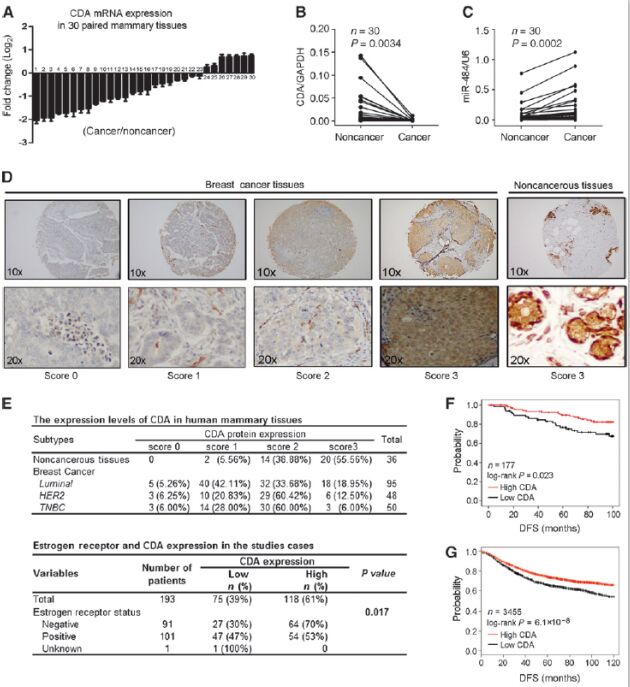
7. CDA表達可作為乳腺癌預后marker
qPCR對30對樣本檢測,發現原發性乳腺癌比其配對癌旁中CDA表達頻繁顯著下調,而miR-484剛好相反。對193原發乳腺癌樣本和36非癌control用IHC檢測CDA蛋白水平發現CDA在94.4%非癌組織中有很強的信號,而在原發腫瘤中比例有所降低(40%)。此外,臨床特征分析表明CDA與乳腺癌ER狀態強烈相關。KM分析表明高CDA表達與長的DFS(disease-free survival)顯著相關。此外,CDA高表達使乳腺癌復發風險降低。以上結果表明CDA表達水平可以作為乳腺癌的預后marker。
研究結論
本研究闡述了乳腺癌吉西他濱抗藥性的分子機制以及乳腺癌細胞中miR-484/CDA可以調節細胞周期。闡述了miR-484調控CDA在調節吉西他濱抗性和細胞周期、細胞增殖中的重要作用,且CDA可以作為乳腺癌預后的marker。
原文出處
Fu-Gui Ye,Chuan-Gui Song, Zhi-Gang Cao,Chen Xia, Dan-Na Chen, Li Chen, ShanLi, Feng Qiao, Hong Ling, Ling Yao, Xin Hu, and Zhi-Ming Shao. Cytidine Deaminase Axis Modulated by miR-484 Differentially Regulates Cell Proliferation and Chemoresistance in Breast Cancer. Cancer research 2015, 75, 1504-15.
- 歐必諾單細胞分選系統介紹會在上海營養與健康所舉辦
- 10x Genomics技術方案更新(4月),新手冊邀您領取
- 南京覃思聯合NBIC成功舉辦三維圖像分析技術培訓會
- 格羅貝爾成為NeuralGlider Inserter超聲推進器代理
- 可持續與AI雙驅動—奧豪斯2025春芽項目年會圓滿舉行
- 共賀百年華誕-賽默飛致敬北京大學生命科學100周年
- 植物生命分析儀破解能量代謝難題開啟植物生命新篇章
- 西美杰成功參加第二十四屆中國生物制品大會
- 從進口到技術領跑:國產高端智能細胞計數儀破局之道
- M2生物芯片點樣儀聯動助力MADx過敏源檢測芯片生產
- 湘儀24周年廠慶:廿四載往昔崢嶸,匠心夢再啟新程
- 博鷺騰Aniview100 Pro中標波蘭科學院采購項目
- 真邁FASTASeq 300 Dx獲批NMPA三類醫療器械注冊證
- 康寧公布2025年第一季度財務業績,強勁表現超出預期
- 慧榮和作為代表出席首屆專精特新小巨人企業生態大會
- M2生物芯片點樣儀聯動助力MADx過敏源檢測芯片生產
- 北京協和醫院邀請英國Kirkstall介紹器官芯片應用
- 英國Kirkstall參展類器官新藥研發與精準醫療大會
- TissUse GmbH公司亮相2024微生理系統國際研討會
- 基爾比精彩亮相環境污染物毒理機制國際研究生論壇
- Kirkstall類器官芯片亮相2024年藥物毒理學年會
- 英國Kirkstall專家受邀參加毒理學會議并做報告
- 3D細胞培養&類器官芯片應用技術研討會圓滿召開
- Kirkstall 3D細胞類器官培養系統亮相毒理學研討會
- 北京基爾比邀您參加類器官前沿應用與3D培養論壇
- 北京基爾比獲器官芯片制造商Kirkstall獨家代理權
- 因美納染色體微陣列芯片CytoSNP-850K 1.4在中國上市
- 2024第12屆上海國際生物芯片及檢測儀器設備展通知
- 2024粵港澳類器官和器官芯片醫工融合發展大會通知
- 類器官技術在精準醫療領域前沿應用研討會圓滿落幕






